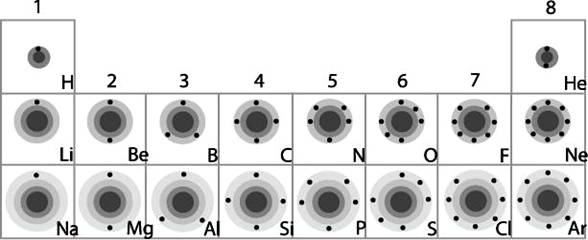
2.1 แบบจำลองอะตอม
2.1.1 แบบจำลองอะตอมของดอลตัน
ในปี พ.ศ. 2346 (ค.ศ. 1803) จอห์น ดอลตัน (John Dalton) นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอะตอม เพื่อใช้อธิบายเกี่ยวกับการเปลี่ยนแปลงของสารก่อนและหลังทำปฏิกิริยา รวมทั้งอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบ ซึ่งสรุปได้ดังนี้1. ธาตุประกอบด้วยอนุภาคเล็กๆหลายอนุภาคเรียกอนุภาคเหล่านี้ว่า “อะตอม” ซึ่งแบ่งแยกและทำให้สูญหายไม่ได้
2. อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน แต่จะมีสมบัติ แตกต่างจากอะตอมของธาตุอื่น
3. สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยา เคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อยๆ
จอห์น ดอลตัน ชาวอังกฤษ เสนอทฤษฎีอะตอมของดอลตัน
- อะตอมเป็นอนุภาคที่เล็กที่สุด แบ่งแยกอีกไม่ได้
- อะตอมของธาตุชนิดเดียวกันมีสมบัติเหมือนกัน
- อะตอมต้องเกิดจากสารประกอบเกิดจากอะตอมของธาตุตั้งแต่ 2 ชนิดขึ้นไปมารวมตัวกันทางเคมี
ทฤษฎีอะตอมของดอลตันใช้อธิบายลักษณะและสมบัติของอะตอมได้เพียงระดับหนึ่ง แต่ต่อมานักวิทยาศาสตร์ค้นพบข้อมูลบางประการที่ไม่สอดคล้องกับทฤษฎีอะตอมของ ดอลตัน เช่น พบว่าอะตอมของธาตุชนิดเดียวกันอาจมีมวลแตกต่างกันได้
ลักษณะแบบจำลองอะตอมของดอลตัน

2.1.2แบบจำลองอะตอมของทอมสัน
เซอร์โจเซฟ จอห์น ทอมสัน นักวิทยาศาสตร์ชาวอังกฤษ ได้ทำการศึกษาและทดลองเกี่ยวกับการนำไฟฟ้าของก๊าซโดยใช้หลอดรังสีแคโทดหลอดรังสีแคโทด
เป็นเครื่องที่ใช่ทดลองเกี่ยวกับการนำไฟฟ้าโดยหลอดรังสีแคโทดจะมีความดันต่ำมาก และความต่างศักย์สูงมาก วิลเลียม ครูกส์ได้สร้างหลอดรังสีแคโทดขึ้นมาโดยใช้แผ่นโลหะ 2 แผ่นเป็นขั้วไฟฟ้า โดยต่อขั้วไฟฟ้าลบกับขั้วลบของเครื่องกำเนิดไฟฟ้าเรียกว่า แคโทด และต่อขั้วไฟฟ้าบวกเข้ากับขั้วบวกของเครื่องกำเนิดไฟฟ้าเรียกว่า แอโนด

การค้นพบอิเล็กตรอน
เซอร์โจเซฟ จอห์น ทอมสัน ดัดแปลงหลอดรังสีใหม่รังสีพุ่งจากด้าแคโทดไปยังด้านแอโนด และจะมีรังสีส่วนหนึ่งทะลุออกไปกระทบกับฉากเรืองแสง ดังรูป


การค้นพบโปรตอน
เนื่องจากอะตอมเป็นกลางทางไฟฟ้า และการที่พบว่าอะตอมของธาตุทุกชนิดประกอบด้วยอิเล็กตรอนซึ่งมีประจุไฟฟ้าเป็นลบ ทำให้นักวิทยาศาสตร์เชื่อว่าองค์ประกอบอีกส่วนหนึ่งของอะตอม จะต้องมีประจุบวกด้วย ออยแกน โกลด์สไตน์ (Eugen Goldstein) นักวิทยาศาสตร์ชาวเยอรมัน ได้ทดลองเกี่ยวกับหลอดรังสีแคโทด โดยดัดแปลงหลอดรังสีแคโทด ดังรูป

ผลการทดลองของโกสไตน์
เมื่อผ่านกระแสไฟฟ้า ปรากฏว่ามีจุดสว่างเกิดขึ้นทั้งฉากเรืองแสง ก. และฉากเรืองแสง ข.
โกลสไตน์ได้อธิบายว่า จุดเรืองแสงที่เกิดขึ้นบนฉากเรืองแสง ก. จะต้องเกิดจากที่ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าบวก เคลื่อนที่ผ่านรูตรงกลางของแคโทด ไปยังฉากเรืองแสง แต่ยังไม่ทราบว่ารังสีที่มีประจุไฟฟ้าบวกนี้เกิดจากอะตอมของก๊าซ หรือเกิดจากอะตอมของขั้วไฟฟ้า และมีลักษณะเหมือนกันหรือไม่
โกลสไตน์ได้ทดลองเปลี่ยนชนิดของก๊าซในหลอดแก้วปรากฏว่าอนุภาคที่มีประจุไฟฟ้าบวกเหล่านี้มีอัตราส่วนประจุต่อมวลไม่เท่ากัน ขึ้นอยู่กับชนิดของก๊าซที่ใช้และเมื่อทดลองเปลี่ยนโลหะที่ใช้ทำเป็นขั้วไฟฟ้าหลายๆชนิดแต่ให้ก๊าซในหลอดแก้วชนิดเดียวกัน ปรากฏว่า ผลการทดลองได้อัตราส่วนประจุต่อมวลเท่ากันแสดงว่าอนุภาคบวกในหลอดรังสีแคโทดเกิดจากก๊าซไม่ได้เกิดจากขั้วไฟฟ้า
สรุปแบบจำลองของทอมสัน
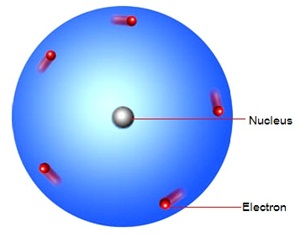
จากผลการทดลอง ทั้งของทอมสันและโกลด์สไตน์ ทำให้ทอมสันได้ข้อมูลเกี่ยวกับอะตอมมากขึ้น จึงได้เสนอแบบจำลองอะตอม ดังนี้ อะตอมมีลักษณะเป็นทรงกลมประกอบด้วยอนุภาคโปรตอนที่มีประจุไฟฟ้าเป็นบวกและอนุภาคอิเล็กตรอนที่มีประจุไฟฟ้าเป็นลบ กระจัดกระจายอย่างสม่ำเสมอในอะตอมอะตอมที่มีสภาพเป็นกลางทางไฟฟ้าจะมีจำนวนประจุบวกเท่ากับจำนวนประจุลบ

2.1.3 แบบจำลองอะตอมของรัทเทอร์ฟอร์ด
แบบจำลองอะตอมของรัทเทอร์ฟอร์ด ลอร์ดเออร์เนสต์ รัทเทอร์ฟอร์ด ได้ทำการทดลอง โดยการยิงอนุภาคแอลฟาไปยังแผ่นทองคำดังรูป

ผลการทดลอง สรุปได้ดังนี้
จุด X เป็นจุดที่อนุภาคแอลฟาผ่านไปยังฉากในแนวเส้นตรง แสดงว่า ภายในอะตอมน่าจะมีพื้นที่ว่างเป็นจำนวนมาก เพราะ อนุภาคแอลฟาส่วนใหญ่ทะลุผ่านแผนทองคำเป็นแนวเส้นตรง

จุด Y อนุภาคแอลฟาเบี่ยงเบนเล็กน้อย แสดงว่าภายในอะตอมควรมีอนุภาคบางอย่างรวมกันเป็นกลุ่มก้อนขนาดเล็ก มีมวลมากพอที่ทำให้อนุภาคแอลฟาวิ่งไปเฉียดแล้วเบี่ยงเบน


การค้นพบนิวตรอน

2. ทอมสันศึกษาหามวลของอนุภาคบวกของ Ne ปรากฎว่า อนุภาคบวกนี้มีมวล 2 เท่า ผลการทดลองนี้สนับสนุนว่าจะต้องมีอนุภาคอีกชนิดหนึ่งอยู่ในนิวเคลียสเชดวิก ได้ยิงอนุภาคแอลฟาไปยัง Be ปรากฎว่าได้อนุภาคชนิดนึ่งออกมาซึ่งมีมวลใกล้เคียงกับมวลของโปรตรอนและไม่มีประจุไฟฟ้า เรียกอนุภาคนี้ว่า "นิวตรอน"
สรุปแบบจำลองอะตอมของรัทเทอร์ฟอร์ด
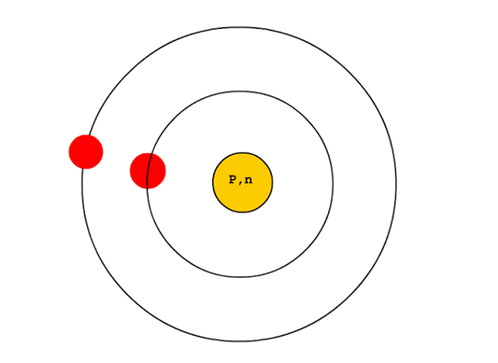
อะตอมประกอบด้วยนิวเคลียสที่มีโปรตอนรวมกันอยู่ตรงกลาง นิวเคลียสมีขนาดเล็ก แต่มีมวลมากและมีประจุเป็นบวก ส่วนอิเล็กตรอนซึ่งมีประจุเป็นลบ และมีมวลน้อยมาก จะวิ่งอยู่รอบนิวเคลียสเป็นบริเวณกว้าง
2.1.4 แบบจำลองอะตอมของโบร์
โบร์ได้ศึกษาแบบจำลองอะตอมขึ้นมาโดยนำแบบจำลองอะตอมของรัทฟอร์ดมาแก้ไข เขาศึกษาสเปกตรัมการเปล่งแสงของธาตุ โดยบรรจุแก๊สไฮโดรเจนในหลอดปล่อยประจุ จากนั้นให้พลังงานเข้าไปผลการทดลอง อิเล็กตรอนเคลื่อนจากขั้วบวกไปขั้วลบชนกับแก๊สไฮโดรเจน จากนั้นเปล่งแสงออกมาผ่านปริซึมทำให้เราเห็นเป็นเส้นสเปกตรัมสีต่าง ๆ ตกบนฉากรับภาพ
สรุปผลการทดลอง
การเปล่งแสงของธาตุไฮโดรเจน เกิดจากอิเล็กตรอนเปลี่ยนระดับพลังงานจากวงโคจรสูงไปสู่วงโคจรต่ำ พร้อมทั้งคายพลังงานในรูปแสงสีต่าง ๆ
สรุปแบบจำลองอะตอมของโบร์
1. อิเล็กตรอนจะอยู่กันเป็นชั้น ๆ แต่ละชั้นเรียกว่า “ระดับพลังงาน”
2. อิเล็กตรอนที่อยู่ในระดับพลังงานวงนอกสุดเรียกว่า เวเลนซ์อิเลคตรอน (Valent electron)จะเป็นอิเล็กตรอน
ที่เกิดปฏิกิริยาต่าง ๆ ได้
3. อิเล็กตรอนที่อยู่ในระดับพลังงานวงในอยู่ใกล้นิวเคลียส จะเสถียรมากเพราะประจุบวกจากนิวเคลียสดึงดูด
ไว้อย่างดี ส่วนอิเล็กตรอนระดับพลังงานวงนอจะไม่เสถียรเพราะนิวเคลียสส่งแรงไปดึงดูดได้น้อยมาก
4. ระดับการพลังงานวงในจะอยู่ห่างกันมาก ส่วนระดับพลังงานวงนอกจะอยู่ชิดกันมาก
5. การเปลี่ยนระดับพลังงานของอิเล็กตรอน ไม่จำเป็นต้องเปลี่ยนในระดับถัดกัน อาจเปลี่ยนข้ามระดับ
พลังงานกันก็ได้
สเปกตรัม
สเปกตรัม หมายถึง อนุกรมของแถบสีหรือ หรือเส้นที่ได้จากการผ่านพลังงานรังสีเข้าไปในสเปกโตรสโคป ซึ่งทำให้พลังงานรังสีแยกออกเป็นแถบหรือเป็นเส้นที่มีความยาวคลื่นต่าง ๆ เรียงลำดับกันไปสเปกตรัมของอะตอม (atomic spectrum)
คลื่นแม่เหล็กไฟฟ้าในช่วงแสงขาวประกอบด้วยแสงที่มีความยาวคลื่นหลายค่าซึ่งเราไม่สามารถแยกส่วนประกอบของคลื่นต่าง ๆ ออกจากกันด้วยตาได้ ต้องใช้เครื่องมือช่วย เช่น ปริซึม หรือสเปกโตรสโคป (spectroscope) เมื่อเราผ่านแสงสีขาวหรือแสงสีต่าง ๆ ไปยังปริซึม แสงจะแยกออกมาเป็นแถบสีต่าง ๆ เรียงกันตามความยาวคลื่น แถบสีที่แยกออกมาได้เรียกว่า สเปกตรัม1. สเปกตรัมแบบต่อเนื่อง (continuous spectrum) จะเป็นสเปกตรัมที่ประกอบด้วยแสงที่มีความยาวคลื่นและความถี่ต่อเนื่องจนเห็นเป็นแถบ ได้แก่ สเปกตรัมของแสงขาวซึ่งจะเห็นเป็นแถบสีรุ้งเรียงต่อกัน โดยแสงสีม่วงหักเหมากที่สุด มีความยาวคลื่นสั้น แต่มีพลังงานมากที่สุด ในขณะที่แสงสีแดงจะหักเหน้อยที่สุด มีความยาวคลื่นยาวที่สุด และมีพลังงานน้อยที่สุด
2. สเปกตรัมแบบไม่ต่อเนื่องหรือแบบเส้น (Discontinuous spectrum or Line spectrum) เป็นสเปกตรัมที่ประกอบด้วยเส้นสเปกตรัมที่มีความยาวคลื่นบางค่าเว้นระยะเป็นเส้น ๆ บนพื้นดำ เนื่องจากสเปกตรัมแต่ละเส้นเป็นคลื่นแม่เหล็กไฟฟ้า เราจึงสามารถคำนวณหาค่าพลังงานของเส้นสเปกตรัมแต่ละเส้นได้จากสมการ
ความยาวคลื่น (Wavelength) l ( แลมบ์ดา ) หมายถึง ระยะทางที่คลื่นเคลื่อนที่ครบ 1 รอบพอดี มีหน่วยเป็นเมตร ( m )
หรือหน่วยย่อยของเมตร เช่น นาโนเมตร (nm) โดย 1 nm = 10-9 เมตร

ความถี่ของคลื่น n (นิว) หมายถึง จำนวนรอบของคลื่นที่เคลื่อนที่ผ่านจุดใดจุดหนึ่งในเวลา 1 วินาที
มีหน่วยเป็นจำนวนรอบต่อวินาที หรือ เฮิร์ตซ์ (Hertz) หรือ Hz
แอมปลิจูด (Amplitude) คือ ความสูงของยอดคลื่น
คลื่นที่จะศึกษากันในที่นี้เป็นคลื่นแม่เหล็กไฟฟ้าในช่วงความยาวคลื่นระหว่าง 380 ถึง 750 nmซึ่งเป็นช่วงคลื่นที่มีความยาวและความถี่ที่ประสาทตาของคนจะรับได้ เรียกคลื่นแม่เหล็กไฟฟ้าช่วงดังกล่าวนี้ว่า “แสงขาว (Visibel light)”

สเปกตรัมคลื่นแม่เหล็กไฟฟ้า
คลื่นแม่เหล็กไฟฟ้าในการทดลองของเฮิรตซ์ มีความยาวคลื่นประมาณ 2.8 เมตร จึงอาจสงสัยว่าคลื่นแม่เหล็กไฟฟ้าในธรรมชาติมีเฉพาะบางความถี่เท่านั้นหรือว่ามีหลายความถี่ ในปัจจุบันได้มีการศึกษาจนทราบว่า คลื่นแม่เหล็กไฟฟ้ามีความถี่ต่างๆ มากมายจนเป็นความถี่ต่อเนื่องกันเป็นช่วงกว้าง คลื่นแม่เหล็กไฟฟ้าที่มีความถี่ต่างๆ เหล่านี้เรียกรวมกันว่า สเปกตรัมคลื่นแม่เหล็กไฟฟ้าเมื่อพิจารณาสเปกตรัมคลื่นแม่เหล็กไฟฟ้า จะเห็นคลื่นแม่เหล็กไฟฟ้าที่มีชื่อเรียกต่างๆกัน ทั้งนึ้ขึ้นกับแหล่งกำเนิดและวิธีตรวจวัดคลื่นนั้น คลื่นในความถี่บางช่วงมีชื่อเรียกไม่เหมือนกัน ทั้งๆ ที่มีความถี่เดียวกัน เนื่องจากมีแหล่งกำเนิดคลื่นต่างกัน เช่น รังสีบางความถี่อาจจะเรียกเป็นรังสีอัลตราไวโอเลตหรือรังสีเอกซ์ก็ได้ ขึ้นกับวิธีที่ใช้ผลิตรังสีนั้น
คลื่นแม่เหล็กไฟฟ้าในแต่ละช่วงความถี่จะมีเอกลักษณ์ที่แตกต่างกัน เช่น รังสีอินฟราเรด หรือคลื่นความร้อนที่เกิดจากวัตถุที่มีอุณหภูมิสูง สามารถตรวจจับได้โดยกายสัมผัสแสงที่เกิดจากการปลดปล่อยพลังงานของอะตอม อาจตรวจพบได้ด้วยจักษุสัมผัส รังสีเอกซ์ที่เกิดจากการปลดปล่อยพลังงานของอิเล็กตรอนสามารถตรวจจับได้ง่ายด้วยฟิล์มเอกซเรย์ และคลื่นวิทยุที่เกิดจากการปลดปล่อยพลังงานของอิเล็กตรอนในไฟฟ้ากระแสสลับความถี่สูง สามารถตรวจจับได้ด้วยอุปกรณ์อิเล็กทรอนิกส์ เป็นต้น
กฎของพลังค์ (อังกฤษ: Planck's law) เป็นกฎที่อธิบายสเปคตรัมการแผ่รังสี (spectral radiance) คลื่นแม่เหล็กไฟฟ้าที่ทุกความยาวคลื่นจากวัตถุดำที่อุณหภูมิหนึ่ง ๆ กฎนี้ค้นพบโดย มักซ์ พลังค์ นักฟิสิกส์ชาวเยอรมัน
กฎของพลังค์เขียนในรูปฟังก์ชันของความถี่  ได้เป็น
ได้เป็น
 ได้เป็น
ได้เป็นหรือเขียนในรูปฟังก์ชันของความยาวคลื่น λ ได้เป็น

โปรดสังเกตว่าสองสมการมีหน่วยต่างกัน สมการแรกหน่วยของสเปคตรัมการแผ่รังสีเป็นต่อความถี่ ส่วนสมการที่สองคิดต่อความยาวคลื่น สมการทั้งสองไม่สามารถแปลงกลับไปมาโดยการแทนตัวแปรตรง ๆ แต่ต้องอาศัยความสัมพันธ์
| เมื่อ | แทน | พลังงานของอะตอมที่รับหรือคายพลังงาน มีหน่วยเป็น จูล (J) | |
| แทน | ค่าคงที่ของแพลงค์ (Planck’s constant) มีค่าเท่ากับ 6.63 x 10-34 J.s | ||
| แทน | เลขจำนวนเต็ม 1 , 2 , 3… เรียกว่าเลขควอนตัม (quantum number) | ||
| แทน | ความถี่ของแสง มีหน่วยเป็นเฮิรตซ์ (Hz) |
ช่วงความยาวคลื่นและพลังงานของแถบสีต่างๆในสเปกตรัมของแสงขาว

แถบสเปกตรัมของแสงขาวและเส้นสเปกตรัมของธาตุบางชนิด
สถานะพื้น (ground state)
หมายถึงอะตอมที่อิเล็กตรอนซึ่งเคลื่อนที่อยู่รอบนิวเคลียสมีพลังงานเฉพาะตัวอยู่ในระดับพลังงานต่ำ อะตอมในสถานะพื้นจะมีความเสถียรเนื่องจากมีพลังงานต่ำ สถานะกระตุ้น (excited state)
หมายถึงอะตอมที่ได้รับพลังงานเพิ่มขึ้น ทำให้อิเล็กตรอนถูกกระตุ้นให้อยู่ในระดับพลังงานสูงขึ้น ที่สถานะกระตุ้นอะตอมจะไม่เสถียร เนื่องจากมีพลังงานสูง

อะตอมที่ได้รับพลังงาน เช่น จากการเผา หรือจากกระแสไฟฟ้า อิเล็กตรอนจะเปลี่ยนจากสถานะพื้นไปสู่สถานะกระตุ้นซึ่งไม่เสถียร จึงต้องคายพลังงานออกมา ซึ่งพลังงานที่คายออกมาจะอยู่ในรูปพลังงานแสงหรือคลื่นแม่เหล็กไฟฟ้า เมื่อผ่านปริซึมหรือสเปกโตรสโคปจะแยกแสงออกเป็นเส้นสเปกตรัม
การที่ธาตุแต่ละชนิดให้เส้นสเปกตรัมออกมาหลายเส้น แสดงว่าอิเล็กตรอนที่อยู่รอบนิวเคลียสมีหลายระดับพลังงาน ระดับพลังงานที่อยู่ใกล้นิวเคลียสจะมีพลังงานต่ำ ส่วนระดับพลังงานที่อยู่ห่างนิวเคลียสจะมีพลังงานสูง เมื่ออิเล็กตรอนคายพลังงานอาจคายพลังงานได้หลายช่วงความยาวคลื่น จึงมองเห็นเส้นสเปกตรัมได้หลายเส้น
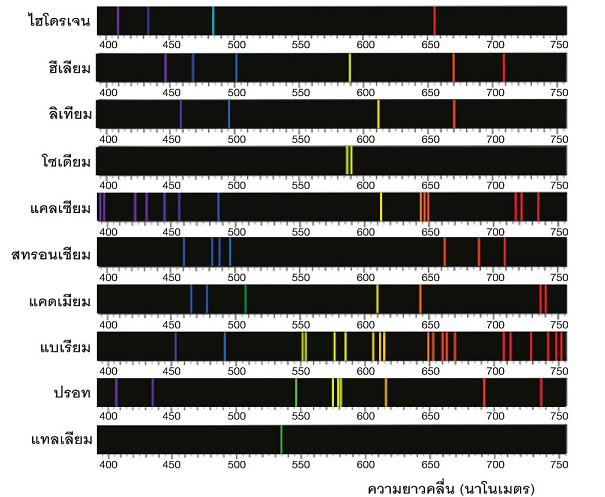
นักวิทยาศาสตร์ได้ศึกษาสเปกตรัมของแก๊ส เพราะว่ามีอะตอมอยู่ห่างกัน และใช้อะตอมไฮโดรเจนเนื่องจากมี 1 อิเล็กตรอน พบว่ามีเส้นสเปกตรัมที่ปรากฏในช่วงความยาวคลื่นที่มองเห็นได้โดยมีความยาวคลื่น 410 , 434 , 486 และ 656 นาโนเมตร ตามลำดับ นอกจากนี้การศึกษาเส้นสเปกตรัมของอะตอมของธาตุอื่นๆ ก็พบว่าอิเล็กตรอนในอะตอมของแต่ละธาตุคายพลังงานได้บางค่า และมีเส้นสเปกตรัมเฉพาะตัวไม่ซ้ำกัน โดยเส้นสีแดงมีพลังงานต่ำสุด (3.02 x 10–22 kJ) และเส้นสีม่วงมีพลังงานสูงสุด (4.48 x 10–22 kJ)

นักวิทยาศาสตร์ได้ศึกษาสเปกตรัมของแก๊ส เพราะว่ามีอะตอมอยู่ห่างกัน และใช้อะตอมไฮโดรเจนเนื่องจากมี 1 อิเล็กตรอน พบว่ามีเส้นสเปกตรัมที่ปรากฏในช่วงความยาวคลื่นที่มองเห็นได้โดยมีความยาวคลื่น 410 , 434 , 486 และ 656 นาโนเมตร ตามลำดับ นอกจากนี้การศึกษาเส้นสเปกตรัมของอะตอมของธาตุอื่นๆ ก็พบว่าอิเล็กตรอนในอะตอมของแต่ละธาตุคายพลังงานได้บางค่า และมีเส้นสเปกตรัมเฉพาะตัวไม่ซ้ำกัน โดยเส้นสีแดงมีพลังงานต่ำสุด (3.02 x 10–22 kJ) และเส้นสีม่วงมีพลังงานสูงสุด (4.48 x 10–22 kJ)


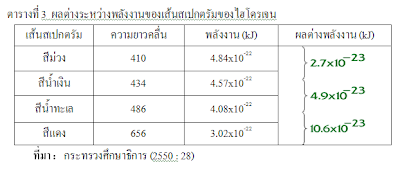



จากข้อมูลในตาราง แสดงว่าอะตอมของไฮโดรเจนมีพลังงานหลายระดับและความแตกต่างระหว่างพลังงานของแต่ละระดับที่อยู่ถัดไปก็ไม่เท่ากัน ความแตกต่างของพลังงานจะมีค่าน้อยลงเมื่อระดับพลังงานสูงขึ้น จากเหตุผลที่อธิบายมานี้ช่วยให้สรุปได้ว่า
1. เมื่ออิเล็กตรอนได้รับพลังงานในปริมาณที่เหมาะสม อิเล็กตรอนจะขึ้นไปอยู่ในระดับพลังงานที่สูงกว่าระดับพลังงานเดิม แต่จะอยู่ในระดับใดขึ้นกับปริมาณพลังงานที่ได้รับ การที่อิเล็กตรอนขึ้นไปอยู่ในระดับพลังงานใหม่ทำให้อะตอมไม่เสถียร อิเล็กตรอนจะกลับมาอยู่ในระดับพลังงานที่ต่ำกว่า ซึ่งในการเปลี่ยนตำแหน่งนี้อิเล็กตรอนจะคายพลังงานออกมา การดูดหรือคายพลังงานจะต้องมีค่าเฉพาะตามทฤษฎีของพลังค์ โดยค่าต่ำสุดจะเท่ากับความถี่ของอิเล็กตรอนนั้นคูณด้วยค่าคงที่ของพลังค์
2. การเปลี่ยนระดับพลังงานของอิเล็กตรอนไม่จำเป็นต้องเปลี่ยนไปยังระดับพลังงานที่อยู่ติดกันอาจมีการเปลี่ยนข้ามระดับได้ แต่เมื่ออิเล็กตรอนรับพลังงานแล้วจะขึ้นไปอยู่ระหว่างระดับพลังงานไม่ได้ จะต้องขึ้นไปอยู่ในระดับใดระดับหนึ่งเสมอ
3. ผลต่างของพลังงานระหว่างระดับพลังงานต่ำจะมีค่ามากกว่าผลต่างของพลังงานระหว่างระดับพลังงานที่สูงขึ้นไป
แบบจำลองอะตอมของโบร์
นีลส์ โบร์ ( Neils Bohr 1885 - 1962 : Denmark )
จากความรู้เรื่องสเปกตรัม นีลส์ โบร์ ได้เสนอแบบจำลองขึ้นมาใหม่โดยปรับปรุงแบบจำลองอะตอมของรัทเทอร์ฟอร์ด เพื่อให้เห็นลักษณะของอิเล็กตรอนที่อยู่รอบ ๆ นิวเคลียส เป็นวงคล้ายกับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ ดังรูป

สรุปแบบจำลองอะตอมของโบร์
1. อิเล็กตรอนจะอยู่เป็นชั้น ๆ แต่ละชั้นเรียกว่า “ ระดับพลังงาน ”2. แต่ละระดับพลังงานจะมีอิเล็กตรอนบรรจุได้ดังนี จำนวนอิเล็กตรอน = 2n2
3. อิเล็กตรอนที่อยู่ในระดับพลังงานนอกสุดเรียกว่า เวเลนซ์อิเล็กตรอน ( Valence electron ) จะเป็นอิเล็กตรอนทีเกิดปฏิกิริยาต่าง ๆ ได้
4. อิเล็กตรอนที่อยู่ในระดับพลังงานวงใน อยู่ใกล้นิวเคลียสจะเสถียรมาก เพราะประจุบวกจากนิวเคลียสดึงดูดเอาไว้อย่างดี ส่วนอิเล็กตรอนระดับพลังงานวงนอกจะไม่เสถียรเพราะนิวเคลียสส่งแรงไปดึงดูดได้น้อยมาก จึงทำให้อิเล็กตรอนเหล่านี้หลุดออกจากอะตอมได้ง่าย
5. ระดับพลังงานวงในจะอยู่ห่างกันมาก ส่วนระดับพลังงานวงนอกจะอยู่ชิดกันมาก
6. การเปลี่ยนระดับพลังงานของอิเล็กตรอน ไม่จำเป็นต้องเปลี่ยนในระดับถัดกัน อาจเปลี่ยนข้ามระดับพลังงานก็ได้
4. อิเล็กตรอนที่อยู่ในระดับพลังงานวงใน อยู่ใกล้นิวเคลียสจะเสถียรมาก เพราะประจุบวกจากนิวเคลียสดึงดูดเอาไว้อย่างดี ส่วนอิเล็กตรอนระดับพลังงานวงนอกจะไม่เสถียรเพราะนิวเคลียสส่งแรงไปดึงดูดได้น้อยมาก จึงทำให้อิเล็กตรอนเหล่านี้หลุดออกจากอะตอมได้ง่าย
5. ระดับพลังงานวงในจะอยู่ห่างกันมาก ส่วนระดับพลังงานวงนอกจะอยู่ชิดกันมาก
6. การเปลี่ยนระดับพลังงานของอิเล็กตรอน ไม่จำเป็นต้องเปลี่ยนในระดับถัดกัน อาจเปลี่ยนข้ามระดับพลังงานก็ได้
สรุปการเกิดสเปกตรัม
1. การตรวจหาสเปกตรัม ถ้าเป็นสารประกอบทำโดย การเผาสารประกอบถ้าเป็นก๊าซทำโดย นำก๊าซมาบรรจุในหลอดแก้ว แล้วปรับความดันให้ต่ำแล้วใช้พลังงานไฟฟ้าแทนการเผา2. สีเปลวไฟ หรือสเปกตรัม เกิดจากสาเหตุเดียวกัน ข้อแตกต่าง คือสีเปลวไฟ เป็นสีที่มองจากตาเปล่า จะเห็นเป็นสีเดียว ซึ่งเป็นสีที่เด่นชัดที่สุด สีสเปกตรัมเป็นสีที่ใช้เครื่องมือ สเปกโตรสโคป ส่องดูเปลวไฟ จะเห็นเป็นเส้นสเปกตรัมหลายเส้น และความเข้มมากที่สุดจะเป็นสีเดียวกันกับสีของเปลวไฟ
3. สีของเปลวไฟ หรือสีของสเปกตรัมเป็นสีที่เกิดที่เกิดจากส่วนที่เป็นไอออนของโลหะ หรือไอออนบวกนั่นเอง ดังเช่น
Li+ สีแดง , Na+ สีเหลือง , K+ สีม่วง , Ca2+ สีแดงอิฐ ,
Ba2+ สีเขียวอมเหลือง , Cu2+ สีเขียว
4. ธาตุแต่ละธาตุมีเส้นสเปกตรัมเป็นลักษณะเฉพาะตัวไม่ซ้ำกัน การจัดอิเล็กตรอนในอะตอม จากการศึกษาแบบจำลองอะตอมของบอห์ร ทำให้ทราบว่า การจัดอิเล็กตรอนในระดับพลังงานต่างๆระดับพลังงาน(n) จำนวนอิเล็คตรอนที่มีได้สูงสุด
n = 1 2
n = 2 8
n = 3 18
n = 4 32
n = 5 50
n = 6 72
n = 7 98

เวเลนซ์อิเล็กตรอน คือ จำนวนอิเล็กตรอนในระดับพลังงานนอกสุดหรือสูงสุด ของแต่ละธาตุจะมีอิเล็กตรอนไม่เกิน 8
การจัดอิเล็กตรอน มีความสัมพันธ์กับการจัดหมู่และคาบอย่างไร
1. เวเลนซ์อิเล็กตรอน จะตรงกับเลขที่ของหมู่ ดังนั้น ธาตุที่อยู่หมู่เดียวกันจะมีเวเลนซ์อิเล็กตรอนเท่ากัน2. จำนวนระดับพลังงาน จะตรงกับเลขที่ของคาบ ดังนั้น ธาตุในคาบเดียวกันจะมีจำนวนระดับพลังงานเท่ากัน เช่น 35Br มีการจัดเรียงอิเล็กตรอนดังนี้ 2 , 8 , 18 , 7 ดังนั้น Br จะอยู่ในหมู่ที่ 7 เพราะมีเวเลนซ์อิเล็กตรอน 7 และอยู่ในคาบที่ 4 เพราะมีจำนวนระดับพลังงาน 4
หลักการจัดเรียงอิเล็กตรอน
1. จะต้องจัดเรียงอิเล็กตรอนเข้าในระดับพลังงานต่ำสุดให้เต็มก่อน จึงจัดให้อยู่ระดับพลังงานถัดไป2. เวเลนซ์อิเล็กตรอนจะเกิน 8 ไม่ได้
3. จำนวนอิเล็กตรอนในระดับพลังงานถัดเข้าไปของธาตุในหมู่ IA , IIA เท่ากับ 8 ส่วนหมู่ IIIA – VIIIA เท่ากับ 18
2.1.5แบบจำลองอะตอมแบบกลุ่มหมอก
แบบจำลองอะตอมแบบกลุ่มหมอก แบบจำลองอะตอมของโบร์ ใช้อธิบายเกี่ยวกับเส้นสเปกตรัมของธาตุไฮโดรเจนได้ดี แต่ไม่สามารถอธิบายเส้นสเปกตรัมของอะตอมที่มีหลายอิเล็กตรอนได้ จึงได้มีการศึกษาเพิ่มเติม โดยใช้ความรู้ทางกลศาสตร์ควันตัม สร้างสมการเพื่อคำนวณหาโอกาสที่จะพบอิเล็กตรอนในระดับพลังงานต่างๆ จึงสามารถอธิบายเส้นสเปกตรัมของธาตุได้ถูกต้องกว่าอะตอมของโบร์ ลักษณะสำคัญของแบบจำลองอะตอมแบบกลุ่มหมอกอธิบายได้ดังนี้1. อิเล็กตรอนเคลื่อนที่รอบนิวเคลียสอย่างรวดเร็วตลอดเวลาด้วยความเร็วสูง ด้วยรัศมีไม่แน่นอนจึงไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนได้บอกได้แต่เพียงโอกาสที่จะพบอิเล็กตรอนในบริเวณต่างๆ ปรากฏการณ์แบบนี้นี้เรียกว่ากลุ่มหมอกของอิเล็กตรอน บริเวณที่มีกลุ่มหมอกอิเล็กตรอนหนาแน่น จะมีโอกาสพบอิเล็กตรอนมากกว่าบริเวณที่เป็นหมอกจาง
2. การเคลื่อนที่ของอิเล็กตรอนรอบนิวเคลียสอาจเป็นรูปทรงกลมหรือรูปอื่น ๆ ขึ้นอยู่กับระดับพลังงานของอิเล็กตรอน แต่ผลรวมของกลุ่มหมอกของอิเล็กตรอนทุกระดับพลังงานจะเป็นรูปทรงกลม
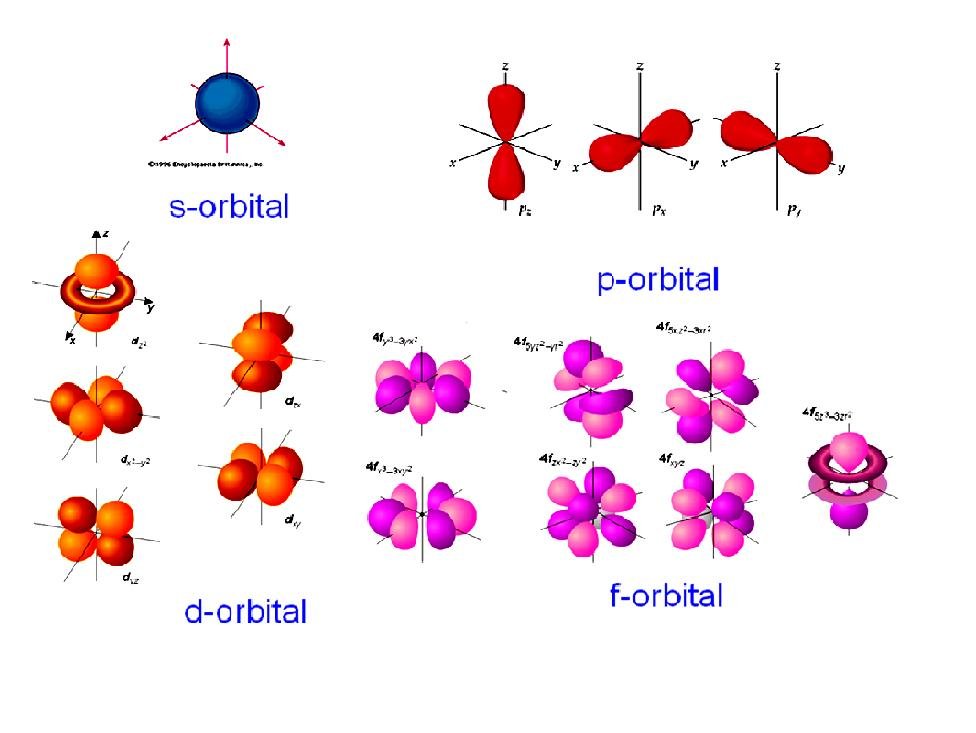
รูปทรงต่างๆของกลุ่มหมอกอิเล็กตรอน จะขึ้นอยู่กับระดับพลังงานของอิเล็กตรอน การใช้ทฤษฎีควันตัม จะสามารถอธิบายการจัดเรียงตัวของอิเล็กตรอนรอบนิวเคลียส ได้ว่าอิเล็กตรอนจัดเรียงตัวเป็นออร์บิทัล(orbital) ในระดับพลังงานย่อย s , p , d , f แต่ละออร์บิทัล จะบรรจุอิเล็กตรอนเป็นคู่ ดังนี้
s – orbital มี 1 ออร์บิทัล หรือ 2 อิเล็กตรอน
p – orbital มี 3 ออร์บิทัล หรือ 6 อิเล็กตรอน
d – orbital มี 5 ออร์บิทัล หรือ 10 อิเล็กตรอน
f – orbital มี 7 ออร์บิทัล หรือ 14 อิเล็กตรอน

s – orbital มีลักษณะเป็นทรงกลม
p – orbital มีลักษณะเป็นกรวยคล้ายหยดน้ำ ลักษณะแตกต่างกัน 3 แบบ ตามจำนวนอิเล็กตรอนใน 3 ออร์บิทัล คือ Px , Py , Pz
d – orbital มีลักษณะและรูปทรงของกลุ่มหมอก แตกต่างกัน 5 แบบ ตามจำนวนอิเล็กตรอนใน 5 ออร์บิทัล คือ dx2-y2 , dz2 , dxy , dyz , dxz
2.2.1อนุภาคในอะตอม
ในปี พ.ศ.2452 (ค.ศ.1909) รอเบิร์ต แอนดรูส์ มิลลิแกน (Robert Millikan) นักวิทยาศาสตร์ชาวอเมริกา ได้ทำการทดลองชื่อ “การทดลองหยดน้ำมันของมิลลิแกน” (Millikan oil–drops experiment) หาประจุของอิเล็กตรอนได้ มีค่าเท่ากับ 1.6 x 10–19 คูลอมบ์
ผลงานการทดลองของมิลลิแกน มีดังนี้

มิลลิแกน ได้ทำการทดลองเพื่อหาค่าประจุของอิเล็กตรอนโดยวิธีหยดน้ำมัน ทำได้โดย พ่นน้ำมันเป็นละอองเม็ดเล็ก ๆ ให้ตกลงมาระหว่างแผ่นโลหะ 2 แผ่น แล้วใช้รังสีเอกซ์ไปดึงอิเล็กตรอนออกจากอะตอมของก๊าซในอากาศ แล้วให้อิเล็กตรอนไปเกาะหยดน้ำมัน พบว่า แต่ละหยดน้ำมันมีอิเล็กตรอนมาเกาะจำนวนไม่เท่ากัน นั่นคือ หยดน้ำมันบางหยดมีอิเล็กตรอนเกาะติดเพียงตัวเดียว บางหยดก็มีมากกว่า 1 ตัว หยดน้ำมันจะตกลงมาตามแรงโน้มถ่วงของโลก จากนั้นให้กระแสไฟฟ้าเข้าไปในแผ่นประจุบวกและลบ แผ่นประจุลบซึ่งอยู่ด้านล่างผลักหยดน้ำมันที่มีอิเล็กตรอนมาเกาะจนหยุดนิ่ง ซึ่งดูได้ด้วยกล้องจุลทรรศน์(microscope) แสดงว่า แรงโน้มถ่วงของโลกเท่ากับแรงจากสนามไฟฟ้า แล้วคำนวณหาค่าประจุ
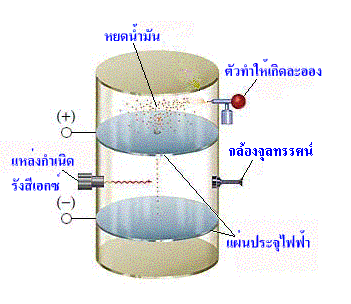
จากผลการทดลองมิลลิแกนคำนวณหาค่าประจุของอิเล็กตรอนได้คือ 1.60 X 10-19 คูลอมบ์ ซึ่งเป็นค่าประจุของอิเล็กตรอน 1 อิเล็กตรอน 
จากการทดลองของมิลลิแกน เราทราบค่า e = 1.60 X 10-19 คูลอมบ์
จากการทดลองของทอมสัน เราทราบค่า e/m = 1.76 X 108 คูลอมบ์/กรัม
m = 9.11 X 10-28 กรัม
ดังนั้น เราจะทราบมวลของอิเล็กตรอนเท่ากับ 9.11 X 10-28 กรัม
ออยเกน โกลด์ชไตน์ (5 กันยายน 1850 - 26 ธันวาคม 1930) เป็นนักฟิสิกส์เยอรมัน เขาเป็นผู้ทดลองหลอดรังสีแคโทด เป็นผู้ค้นพบรังสีบวกและเป็นผู้ที่ค้นพบโปรตอนเป็นคนแรก
นปี พ.ศ. 2409 (ค.ศ. 1866) ออยเกน โกลด์ชไตน์ ได้ทำการทดลองโดยเจาะรูที่ขั้วแคโทดในหลอดรังสีแคโทด พบว่าเมื่อผ่านกระแสไฟฟ้าเข้าไปในหลอดรังสีแคโทดจะมีอนุภาคชนิดหนึ่งเคลื่อนที่เป็นเส้นตรงไปในทิศทางตรงกันข้ามกับการเคลื่อนที่ของรังสีแคโทดผ่านรูของขั้วแคโทด และทำให้ฉากด้านหลังขั้วแคโทดเรืองแสงได้ โกลด์ชไตน์ได้ตั้งชื่อว่า “รังสีแคแนล” (canal ray) หรือ “รังสีบวก” (positive ray) สมบัติของรังสีบวกมีดังนี้1. เดินทางเป็นเส้นตรงไปยังขั้วแคโทด
2. เมื่อผ่านรังสีนี้ไปยังสนามแม่เหล็กและสนามไฟฟ้า รังสีนี้จะเบี่ยงเบนไปในทิศทางตรงข้ามกับรังสีแคโทด แสดงว่ารังสีนี้ประกอบด้วยอนุภาคที่มีประจุไฟฟ้าเป็นบวก
3. มีอัตราส่วนประจุต่อมวลไม่คงที่ ขึ้นอยู่กับชนิดของแก๊สในหลอด และถ้าเป็นแก๊สไฮโดรเจนรังสีนี้จะมีอัตราส่วนประจุต่อมวลสูงสุด เรียกอนุภาคบวกในรังสีแคแนลของไฮโดรเจนว่า “โปรตอน”
4. มีมวลมากกว่ารังสีแคโทด เนื่องจากความเร็วในการเคลื่อนที่ต่ำกว่ารังสีแคโทด
การหาค่าประจุต่อมวล e/m ของอนุภาคบวก โกลด์ชไตน์หาค่า e/m ได้ดังนี้
e/m ของอนุภาคบวกมีค่าไม่คงที่ขึ้นอยู่กับธาตุแต่ละชนิด เพราะอะตอมของก๊าซแต่ละชนิดมีมวลไม่เท่ากัน จึงทำให้ค่าประจุต่อมวลของอนุภาคบวกมีค่าไม่เท่ากัน
สำหรับค่าประจุต่อมวล e/m ของก๊าซไฮโดรเจนหรือโปรตอน จะมีค่าดังนี้
e/m = 9.58 x 104 คูลอมบ์/กรัม
มวลของโปรตอน = 1.6 x 10-19 / 9.58 x 104
มวลของโปรตอน = 1.66 x 10-24 g
e/m ของอนุภาคบวกมีค่าไม่คงที่ขึ้นอยู่กับธาตุแต่ละชนิด เพราะอะตอมของก๊าซแต่ละชนิดมีมวลไม่เท่ากัน จึงทำให้ค่าประจุต่อมวลของอนุภาคบวกมีค่าไม่เท่ากัน
สำหรับค่าประจุต่อมวล e/m ของก๊าซไฮโดรเจนหรือโปรตอน จะมีค่าดังนี้
e/m = 9.58 x 104 คูลอมบ์/กรัม
มวลของโปรตอน = 1.6 x 10-19 / 9.58 x 104
มวลของโปรตอน = 1.66 x 10-24 g
เขาระดมยิงเบริลเลียม(Be)ด้วยอนุภาคแอลฟา(
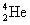 ) ซึ่งได้จากธาตุพอโลเนียม(Po)
) ซึ่งได้จากธาตุพอโลเนียม(Po)จากนั้น ทดลองซ้ำโดยเปลี่ยนเบริลเลียมเป็นธาตุอื่น เช่น โบรอน(B), ไนโตรเจน(N), ออกซิเจน(O), อาร์กอน(Ar) ฯลฯ
ผลการทดลอง
จากการทดลองพบว่า เมื่อระดมยิงเบริลเลียม(Be)ด้วยอนุภาคแอลฟา(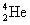 )จะตรวจพบ
)จะตรวจพบ 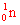 ดังสมการ
ดังสมการ
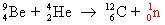
นอกจากนั้น เขายังทำการทดลองกับโบรอน(B)
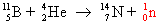
และ เขายังทำการทดลองกับไนโตรเจน(N), ออกซิเจน(O), อาร์กอน(Ar) ฯลฯ ทุกครั้งที่เขาทำการทดลอง เขาจะตรวจพบ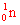 ทุกครั้ง
ทุกครั้ง
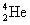 )จะตรวจพบ
)จะตรวจพบ 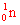 ดังสมการ
ดังสมการ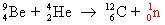
นอกจากนั้น เขายังทำการทดลองกับโบรอน(B)
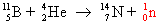
และ เขายังทำการทดลองกับไนโตรเจน(N), ออกซิเจน(O), อาร์กอน(Ar) ฯลฯ ทุกครั้งที่เขาทำการทดลอง เขาจะตรวจพบ
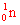 ทุกครั้ง
ทุกครั้งสรุปผลการทดลอง
เขาพบอนุภาคใหม่คือ
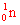 เขาให้ชื่ออนุภาคนี้ว่า "นิวตรอน" ซึ่งมีมวลใกล้เคียงโปรตอนและเป็นกลาง ทางไฟฟ้า ด้วยคุณสมบัติของนิวตรอนคือเป็นกลางทางไฟฟ้า จึงไม่เบี่ยงเบนในหลอดรังสีแคโทดทำให้นักวิทยาศาสตร์ค้นพบอนุภาคนี้ช้าที่สุด
เขาให้ชื่ออนุภาคนี้ว่า "นิวตรอน" ซึ่งมีมวลใกล้เคียงโปรตอนและเป็นกลาง ทางไฟฟ้า ด้วยคุณสมบัติของนิวตรอนคือเป็นกลางทางไฟฟ้า จึงไม่เบี่ยงเบนในหลอดรังสีแคโทดทำให้นักวิทยาศาสตร์ค้นพบอนุภาคนี้ช้าที่สุดการค้นพบนิวตรอนทำให้โครงสร้างอะตอมของดาลตัน, ทอมสันและรัทเทอร์ฟอร์ดไม่ถูกต้อง เพราะไม่มีนิวตรอนในโครงสร้างอะตอม จึงเกิดการเปลี่ยนแปลงแนวความคิดของนักวิทยาศาสตร์ในเรื่องโครงสร้างอะตอม หลังจากนั้นจึงเกิดโครงสร้างอะตอมของโบร์ขึ้นมาแทนที่โครงสร้างอะตอมแบบเดิม ๆ

2.2.2เลขอะตอม เลขมวล และไอโซโทป
จากการศึกษาเกี่ยวกับโครงสร้างของอะตอม โดยมีข้อมูลต่างๆ จากการทดลองมาสนับสนุน สรุปได้ว่า อะตอมของธาตุต่างๆ จะประกอบด้วยอิเล็กตรอน โปรตอนและนิวตรอน (ยกเว้นอะตอมของธาตุไฮโดรเจน ที่ไม่มีนิวตรอน) ซึ่งมีจำนวนแตกต่างกันไป เลขที่แสดงจ้านวนโปรตอนในนิวเคลียสของอะตอม เรียกว่าเลขอะตอม (atomic number, Z) เลขอะตอมจะเป็นค่าเฉพาะของธาตุ ธาตุชนิดเดียวกันจะมีเลขอะตอมเท่ากันเสมอ ซึ่งที่สภาวะปกติจะมีจำนวนโปรตอนและอิเล็กตรอนเท่ากัน ส่วนเลขที่แสดงจำนวนผลบวกของโปรตอนและจำนวนนิวตรอน เราเรียกว่า เลขมวล (mass number, A) ซึ่งในนิวเคลียสของอะตอม เลขมวลจะมีค่าใกล้เคียงกับเลขของอะตอม โดยผลต่างของเลขมวลกับเลขของอะตอมจะเท่ากับจำนวนนิวตรอนโดยสามารถเขียนสัญลักษณ์นิวเคลียร์ได้ คือ
เลขอะตอม คือ จำนวนโปรตอนในนิวเคลียสของแต่ละอะตอมของธาตุ ในอะตอมที่เป็นกลางจะมีจำนวนโปรตอนเท่ากับจ้านวนอิเล็กตรอน ดังนั้นเลขเชิงอะตอมจึงบอกจำนวนของอิเล็กตรอนของธาตุได้ด้วย เนื่องจากอะตอมของธาตุชนิดเดียวกันมีค่าเลขเชิงอะตอมเท่ากันเสมอ เลขเชิงอะตอมจึงป็นเอกลักษณ์ของธาตุชนิดเดียวกัน เช่น เลขเชิงอะตอมของฟอสฟอรัสเท่ากับ 15 นั้นคือทุกๆ อะตอมที่เป็นกลางของฟอสฟอรัสจะมี 15 โปรตอน และมี 15 อิเล็กตรอน และกล่าวได้ว่าอะตอมใดๆ ในจักรวาลถ้ามี 15 โปรตอนแล้ว จะเรียกว่า “ฟอสฟอรัส” ทั้งสิ้น
ทั้งหมดจะมีทั้งโปรตอนและนิวตรอนอยู่ โดยทั่วไปแล้วเลขมวลหาได้ดังนี้
เลขมวล = จำนวนโปรตอน + จำนวนนิวตรอน
= เลขอะตอม + จำนวนนิวตรอน
จำนวนนิวตรอนในอะตอม = เลขมวล – เลขอะตอม
เช่น 2311Na ธาตุโซเดียม มีจำนวนโปรตอน (Z) = 11
มีจำนวนนิวตรอน = A – Z = 23 – 11 = 12
มีจำนวนอิเล็กตรอน = 11 (เท่ากับจำนวนโปรตอน)
ไอโซโทป (isotope) หมายถึง อะตอมของธาตุชนิดเดียวกันที่มีเลขอะตอม (Z) เท่ากัน แต่เลขมวล (A) ไม่เท่ากัน ตัวอย่างเช่น อะตอมของไฮโดรเจนมีเลขมวลสามชนิดโดยแตกต่างกันที่จำนวนนิวตรอน ได้แก่
ไฮโดรเจน (Hydrogen) มี 1 โปรตอนและไม่มีนิวตรอน มีสัญลักษณ์ 11H
ดิวทีเรียม (Deuterium) มี 1 โปรตอนและมี 1 นิวตรอน มีสัญลักษณ์ 21H
ทริเทียม (Tritium) มี 1 โปรตอนและมี 2 นิวตรอน มีสัญลักษณ์ 31H
สมบัติทางเคมีของธาตุถูกก้าหนดโดยจำนวนโปรตอนและอิเล็กตรอนในอะตอม นิวตรอนไม่มีส่วนเกี่ยวข้องในการเปลี่ยนแปลงทางเคมีตามปกติ ดังนั้นไอโซโทปของธาตุเดียวกันจึงมีสมบัติทางเคมีเหมือนกันเกิดสารประกอบประเภทเดียวกันและมีความไวต่อปฏิกิริยาเคมีไอโซโทน (isotone) หมายถึง อะตอมของธาตุต่างชนิดกันที่มีจำนวนนิวตรอนเท่ากัน แต่จำนวนโปรตอน เลขอะตอมและเลขมวลไม่เท่ากัน เช่น 3919K 4020Ca มีนิวตรอนเท่ากัน คือ 20
ไอโซบาร์ (isobar) หมายถึง อะตอมของธาตุต่างชนิดกันที่มีเลขมวลเท่ากันแต่เลขอะตอมต่างกัน เช่น 146C 147N
2.3การจัดเรียงอิเล็กตรอนในอะตอม
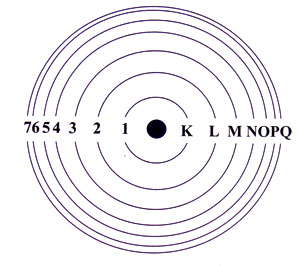
2.3.1จำนวนอิเล็กตรอนในแต่ละระดับพลังงาน
อิเล็กตรอนในอะตอมที่อยู่ ณ ระดับพลังงาน (energy levels หรือ shell) จะมีพลังงานจำนวนหนึ่ง ส้าหรับอิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดจะมีพลังงานน้อยกว่าพวกที่อยู่ไกลออกไป ยิ่งอยู่ไกลมากยิ่งมีพลังงานมากขึ้น โดยกำหนดระดับพลังงานหลักให้เป็น n ซึ่ง n เป็นจ้านวนเต็มคือ 1, 2, … หรือตัวอักษรเรียงกันดังนี้ คือ K, L, M, N, O, P, Q ตามล้าดับ เมื่อ n = 1 จะเป็นระดับพลังงานต่ำสุด หมายความว่า จะต้องใช้พลังงานมากที่สุดที่จะดึงเอาอิเล็กตรอนนั้นออกจากอะตอมได้ จำนวนอิเล็กตรอนที่จะมีได้ในแต่ละระดับพลังงานหลักต้องเท่ากับหรือไม่เกิน 2n2 และจำนวนอิเล็กตรอนในระดับนอกสุดจะต้องไม่เกิน 8 เช่น
ระดับพลังงานที่หนึ่ง n = 1 (shell K) ปริมาณอิเล็กตรอนที่ควรมีอยู่ = 2(1)2 = 2
ระดับพลังงานที่สอง (n = 2) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(2)2 = 8
ระดับพลังงานที่สาม (n = 3) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(3)2 = 18
ระดับพลังงานที่สี่ (n = 4) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(4)2 = 32
ระดับพลังงานที่ห้า (n = 5) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(5)2 = 50
ระดับพลังงานที่หก (n = 6) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(6)2 = 72
ระดับพลังงานที่เจ็ด (n = 7) ปริมาณอิเล็กตรอนสูงสุดที่ควรมีได้ = 2(7)2 = 98

2.3.2ระดับพลังงานหลัก และระดับพลังงานย่อย

จากการศึกษาสเปกตรัมของธาตุต่างๆ พบว่าในระดับพลังงานหลัก (n) ยังประกอบด้วยระดับพลังงานย่อยหรือเรียกว่า ซับเซลล์ (sub-levels หรือ sub-shells) โดยก้าหนดเป็นสัญลักษณ์คือ s p d และ f ซึ่งในแต่ละระดับพลังงานย่อยจะมีอิเล็กตรอนได้ไม่เท่ากันและมีพลังงานไม่เท่ากัน กล่าวคือ ระดับพลังงานย่อย s มีพลังงานต่ำกว่า p ต่ำกว่า d ต่ำกว่า f ตามล้าดับ ในระดับพลังงานย่อยยังประกอบด้วยออร์บิทัล (orbital) ซึ่งในแต่ละออร์บิทัลมีอิเล็กตรอนได้ไม่เกิน 2 อิเล็กตรอน ดังนี้
ระดับพลังงานย่อย s มีอิเล็กตรอนได้ไม่เกิน 2 อิเล็กตรอน มี 1 ออร์บิทัล
ระดับพลังงานย่อย p มีอิเล็กตรอนได้ไม่เกิน 6 อิเล็กตรอน มี 3 ออร์บิทัล
ระดับพลังงานย่อย d มีอิเล็กตรอนได้ไม่เกิน 10 อิเล็กตรอน มี 5 ออร์บิทัล
ระดับพลังงานย่อย f มีอิเล็กตรอนได้ไม่เกิน 14 อิเล็กตรอน มี 7 ออร์บิทัล
ภายในระดับพลังงานหลักอันเดียวกันจะประกอบด้วยพลังงานย่อยเรียงล้าดับจากพลังงานต่้าไปสูง คือ จาก s ไป p d และ f เช่น 3p สูงกว่า 3s ซึ่งเมื่อนำมาเรียงลำดับกันแล้ว พบว่ามีเฉพาะ 2 ระดับพลังงานแรกคือ n = 1 และ n = 2 เท่านั้น ที่มีพลังงานเรียงลำดับกัน แต่พอขึ้นระดับพลังงาน n = 3 เริ่มมีการซ้อนเกยกันของระดับพลังงานย่อย ดังรูป
ระดับพลังงานย่อย p มีอิเล็กตรอนได้ไม่เกิน 6 อิเล็กตรอน มี 3 ออร์บิทัล
ระดับพลังงานย่อย d มีอิเล็กตรอนได้ไม่เกิน 10 อิเล็กตรอน มี 5 ออร์บิทัล
ระดับพลังงานย่อย f มีอิเล็กตรอนได้ไม่เกิน 14 อิเล็กตรอน มี 7 ออร์บิทัล
ภายในระดับพลังงานหลักอันเดียวกันจะประกอบด้วยพลังงานย่อยเรียงล้าดับจากพลังงานต่้าไปสูง คือ จาก s ไป p d และ f เช่น 3p สูงกว่า 3s ซึ่งเมื่อนำมาเรียงลำดับกันแล้ว พบว่ามีเฉพาะ 2 ระดับพลังงานแรกคือ n = 1 และ n = 2 เท่านั้น ที่มีพลังงานเรียงลำดับกัน แต่พอขึ้นระดับพลังงาน n = 3 เริ่มมีการซ้อนเกยกันของระดับพลังงานย่อย ดังรูป
2.3.3ออร์บิทัล
อิเล็กตรอนที่วิ่งอยู่รอบ ๆ นิวเคลียสนั้น เราไม่สามารถกำหนดตำแหน่ง ความเร็ว ทิศทางหรือวิถีโคจรได้ แต่เราสามารถคำนวณหาโอกาสที่จะพบอิเล็กตรอนอนุภาคใดอนุภาคหนึ่งขณะใดขณะหนึ่งที่ตำแหน่งต่าง ๆ และศึกษาคุณสมบัติของอิเล็กตรอนได้โดยอาศัยกฎของไฮเซนเบอร์ก (Heisenberg) และสมการคลื่นของโชรดิงเจอร์ (Schroedinger) ขอบเขตที่เราสามารถพบอิเล็กตรอน อนุภาคใดอนุภาคหนึ่ง ในเวลาใดเวลาหนึ่ง เรียกว่าออร์บิทัล (orbital)หรือ หมอกอิเล็กตรอน (electron cloud) กลุ่มของออร์บิทัลที่มีระดับพลังงานเท่ากัน เรียกว่าเชลล์ย่อย (subshell)และกลุ่มของเซลล์ย่อย เรียกว่า เชลล์( shell ) ขนาดและรูปร่างของออร์บิทัลจะขึ้นอยู่กับสภาพพลังงานของอิเล็กตรอนอนุภคนั้น ๆ อิเล็กตรอนที่มีระดับพลังงานต่ำจะมีออร์บิทัลอยู่ใกล้นิวเคลียส อิเล็กตรอนที่มีระดับพลังงานสูงขึ้นจะอยู่ห่างจากนิวเคลียสเป็นระยะทางเพิ่มขึ้น และพบว่าพลังงานของอิเล็กตรอนมีค่าห่างกันเป็นช่วงคงที่ (quantized) เช่น ให้ E1หรือ E2เป็นระดับพลังงานสองระดับที่อยู่ถัดกัน พบว่าอิเล็กตรอนจะอยู่ในระดับพลังงาน E1หรือ E2แต่จะไม่อยู่ระหว่าง E1และ E2เลย ไม่ว่าขณะใด อันนี้เป็นทฤษฎีควอนตัม (quantum theory) ซึ่งใช้เลขควอนตัม (quantum number) สี่ชนิดเพื่อกำหนดพลังงานของอิเล็กตรอนในอะตอม ดังนี้
1. เลขควอนตัมหลัก (the principle quantum number)ใช้กำหนดระดับพลังงานของอิเล็กตรอนในเซลล์ต่าง ๆ ใช้สัญลักษณ์แทนด้วย n ซึ่งมีค่าเป็น 1,2,3,... เมื่อเปรียบเทียบกับเชลล์อิเล็กตรอนในทฤษฎีของบอห์ร (Bohr) จะเห็นได้ว่า n = 1 คือ เชลล์ K n = 2 คือเชลล์ L และ n = 3 คือเชลล์ M เป็นต้น อิเล็กตรอนในแต่ละเชลล์จะมีจำนวนไม่เกิน 2n2อนุภาค เช่น n = 1,2,3,4 จะมีอิเล็กตรอนได้ไม่เกิน 2 , 8, 18 และ 32 อนุภาค ตามลำดับ
2. เลขควอนตัมโมเมนตัมเชิงมุม (The angular-momentum quantum number)ใช้กำหนดโมเมนตัมเชิงมุมของอิเล็กตรอน ซึ่งจะบอกรูปร่างของออร์บิทัลหรือหมอกอิเล็กตรอนนั้น ๆ ใช้สัญลักษณ์แทนด้วย และ มีค่าเป็นเลขจำนวนเต็มขึ้นกับค่า n คทิมีค่าตั้งแต่ 0,1,2,3,...ถึง(n - 1) เช่นเมื่อ n=1 จะมีค่าเท่ากับ 0 ออร์บิทัลย่อยนี้เรียกว่าออร์บิทัล 1s มีรูปร่างเป็นทรงกลมสมมาตรรอบนิวเคลียส ถ้า n = 2 จะมีค่าเป็น 0 และ 1 เรียกว่าออร์บิทัล 2s มีรูปร่างเป็นทรงกลม แต่มีรัศมีใหญ่กว่าออร์บิทัล 1s และมีบริเวณที่เกือบจะไม่มีโอกาสพบอิเล็กตรอน 2s อยู่ระหว่างออร์บิทัล 1s และ 2s เรียกบริเวณนี้ว่า บริเวณโนดัล(nodal surface) และเมื่อ n = 2 เรียกว่าออร์บิทัล p ซึ่งมีรูปร่างคล้ายกับลูกตุ้มยกน้ำหนัก(dumb-bell)
| n | สัญลักษณ์ของเชลล์ย่อย | |
1
2
3
4
|
0
0 1 0 1 2 0 1 2 3 |
1s
2s 2p 3s 3p 3d 4s 4p 4d 4f |
3. เลขควอนตัมแม่เหล็ก (The magnetic quantum number)ใช้กำหนดทิศทางอิเล็กตรอนของออร์บิทัลย่อยในเชลล์ย่อยต่าง ๆ หรือเป็นตัวกำหนดโมเมนตัมเชิงมุมในสนามแม่เหล็ก ใช้สัญลักษณ์แทนด้วย m ค่า m ขึ้นอยู่กับค่า คือมีค่าตั้งแต่ 0 , +1, -1, +2, -2, ... ถึง +, -ดังนั้น
เชลล์ย่อย s จะมี m ได้เพียงค่าเดียวคือ 0
เชลล์ย่อย p จะมี m ได้ 3 ค่า คือ 0 , +1, -1
เชลล์ย่อย d จะมี m ได้ 5 ค่า คือ 0, +1, -1, +2, -2
เชลล์ย่อย f จะมี m ได้ 7 ค่า คือ 0, +1, -1, +2, -2, +3, -3
ตัวอย่างเช่น เมื่อ n = 2 และ= 1 m อาจจะมีค่า – 1, 0 และ 1 นั่นคือ ออร์บิทัล 2 p ซึ่งมีได้สามทิศทางตั้งฉากซึ่งกันและกันในแนวแกน x,y และ z ใช้สัญลักษณ์แทนด้วย PX, PYและ PZดูที่รูป 1-3 เมื่อ n = 3 และ= 2 m อาจจะมีค่า – 2 , -1, 0, 1 และ 2 ใช้สัญลักษณ์แทนด้วย dxy, dyzdzx,,และ เป็นต้น
4. เลขควอนตัมสปิน (The spin quantum number)ใช้กำหนดทิศทางการหมุนเวียนของอิเล็กตรอนว่าอยู่ในทิศทางที่เสริมหรือสวนกับสนามแม่เหล็ก ใช้สัญลักษณ์แทนด้วย s ค่าของ s มี 2 ค่า คือ +1/2 และ – 1/2 อิเล็กตรอนที่มีระดับพลังงานที่มีเลขควอนตัม n,และ m เหมือนกัน คืออยู่ในออร์บิทัลย่อยอันเดียวกัน จะมีอิเล็กตรอนได้เพียง 2 อนุภาค ซึ่งหมุนตรงข้ามกัน
สรุปแล้วมีเลขควอนตัมอยู่สี่ชนิด ที่เกี่ยวข้องกับทางโคจรและระดับพลังงานของอิเล็กตรอน ภาวะปกติระดับพลังงานของอิเล็กตรอนย่อมขึ้นกับค่าเลขควอนตัม n เท่านั้น คือ ระดับพลังงานเป็นอนุกรมดังนี้ 1s<2s=2p<3s=3p=3d<4s=4p=4d=4f< แต่ถ้ามีสนามแม่เหล็กหรือสนามไฟฟ้า ระดับพลังงานของเชลล์ย่อย s, p, d และ f ในแต่ละเชลล์จึงไม่เท่ากัน
2.3.4 หลักการจัดเรียงอิเล็กตรอนในอะตอม
จากการศึกษาแบบจำลองอะตอมโดยใช้สมการทางคณิตศาสตร์ขั้นสูงที่เรียกว่าสมการคลื่น คำนวณหาค่าพลังงานอิเล็กตรอน ทำให้ทราบว่าอะตอมประกอบด้วยโปรตอนและนิวตรอนอยู่รวมกันในนิวเคลียส โดยมีอิเล็กตรอนเคลื่อนที่อยู่รอบ ๆ และอยู่ในระดับพลังงานต่างกัน อิเล็กตรอนเหล่านั้นอยู่กันอย่างไร ในแต่ละระดับพลังงานจะมีจำนวนอิเล็กตรอนสูงสุดเท่าใด ให้นักเรียนพิจารณาข้อมูลจากตารางแสดงการจัดเรียงอิเล็กตรอนของธาตุบางธาตุ
เวเลนซ์อิเล็กตรอน เวเลนซ์อิเล็กตรอน คือ จำนวนอิเล็กตรอนในระดับพลังงานนอกสุดหรือสูงสุด ของแต่ละธาตุจะมีอิเล็กตรอนไม่เกิน 8
การจัดอิเล็กตรอน มีความสัมพันธ์กับการจัดหมู่และคาบอย่างไร
เวเลนซ์อิเล็กตรอน เวเลนซ์อิเล็กตรอน คือ จำนวนอิเล็กตรอนในระดับพลังงานนอกสุดหรือสูงสุด ของแต่ละธาตุจะมีอิเล็กตรอนไม่เกิน 8
การจัดอิเล็กตรอน มีความสัมพันธ์กับการจัดหมู่และคาบอย่างไร
- เวเลนซ์อิเล็กตรอน จะตรงกับเลขที่ของหมู่ ดังนั้น ธาตุที่อยู่หมู่เดียวกันจะมีเวเลนซ์อิเล็กตรอนเท่ากัน
- จำนวนระดับพลังงาน จะตรงกับเลขที่ของคาบ ดังนั้น ธาตุในคาบเดียวกันจะมีจำนวนระดับพลังงานเท่ากัน เช่น 35 Br มีการจัดเรียงอิเล็กตรอนดังนี้ 2 , 8 , 18 , 7 ดังนั้น Br จะอยู่ในหมู่ที่ 7 เพราะมีเวเลนซ์อิเล็กตรอน 7 และอยู่ในคาบที่ 4 เพราะมีจำนวนระดับพลังงาน 4
หลักการจัดเรียงอิเล็กตรอน
- จะต้องจัดเรียงอิเล็กตรอนเข้าในระดับพลังงานต่ำสุดให้เต็มก่อน จึงจัดให้อยู่ระดับพลังงานถัดไป
- เวเลนซ์อิเล็กตรอนจะเกิน 8 ไม่ได้
- จำนวนอิเล็กตรอนในระดับพลังงานถัดเข้าไปของธาตุในหมู่ IA , IIA เท่ากับ 8 ส่วนหมู่ IIIA – VIIIA เท่ากับ 18
การจัดอิเล็กตรอนในระดับพลังงานย่อย จากการศึกษาสเปกตรัมและกลศาสตร์ควันตัมของคลื่น ทำให้ทราบว่า ระดับพลังงานของอิเล็กตรอน ในระดับพลังงานเดียวกัน ยังแบ่งเป็นระดับพลังงานย่อยต่างๆ ซึ่งมี 4 ระดับพลังงานย่อย ได้แก่ s , p , d , f subshell แต่ละระดับพลังงานย่อย จะมีจำนวนอิเล็กตรอนต่างๆกัน
เมื่อพิจารณาข้อมูลในตารางจะพบว่าจำนวนอิเล็กตรอนในระดับพลังงานที่ 1 มีได้มากที่สุดคือ 2 อิเล็กตรอน ระดับพลังงานที่ 2 มีได้มากที่สุด 8 อิเล็กตรอน สำหรับระดับพลังงานที่ 3 นั้น จากการสืบค้นข้อมูลเพิ่มเติมทำให้ทราบว่ามีได้มากที่สุด 18 อิเล็กตรอน
หลักในการจัดเรียงอิเล็กตรอนในแต่ละระดับพลังงานเป็นดังนี้
เมื่อพิจารณาข้อมูลในตารางจะพบว่าจำนวนอิเล็กตรอนในระดับพลังงานที่ 1 มีได้มากที่สุดคือ 2 อิเล็กตรอน ระดับพลังงานที่ 2 มีได้มากที่สุด 8 อิเล็กตรอน สำหรับระดับพลังงานที่ 3 นั้น จากการสืบค้นข้อมูลเพิ่มเติมทำให้ทราบว่ามีได้มากที่สุด 18 อิเล็กตรอน
หลักในการจัดเรียงอิเล็กตรอนในแต่ละระดับพลังงานเป็นดังนี้
- จำนวนอิเล็กตรอนในระดับพลังงานนอกสุด ( valence electron ) มีได้ไม่เกิน 8 อิเล็กตรอน และจำนวนอิเล็กตรอนในระดับพลังงานวงถัดเข้ามามีได้ไม่เกิน 18 อิเล็กตรอน
- ระยะห่างระหว่างแต่ละระดับพลังงานจะไม่เท่ากัน n = 1 และ n = 2 จะอยู่ห่างกันมากที่สุด และระยะห่างระหว่างระดับพลังงานจะน้อยลงเรื่อยๆ เมื่อระดับพลังงานสูงขึ้น
- จำนวนระดับพลังงานของอะตอมของธาตุจะบอกถึง “ คาบ ”
- จำนวนเวเลนซ์อิเล็กตรอนจะบอกถึง “ หมู่ ”
 |

2.4 ตารางธาตุและคุณสมบัติ
หมายถึง ตารางที่นักวิทยาศาสตร์สร้างขึ้นมา เพื่อแบ่งธาตุที่มีสมบัติเหมือนกันออกเป็นหมวดหมู่ เพื่อให้ง่ายแก่การศึกษา โดยแบ่งธาตุทั้งหมดออกเป็นหมู่และคาบ- ธาตุที่อยู่ในแนวดิ่งเดียวกัน เรียกว่า อยู่ใน หมู่ เดียวกัน
- ธาตุที่อยู่ในแนวนอนเดียวกัน เรียกว่า อยู่ใน คาบ เดียวกัน
ในระหว่างปี พ.ศ. 2346 ถึง 2456 มีธาตุต่าง ๆที่พบในธรรมชาติประมาณ 63 ธาตุ ซึ่งนักวิทยาศาสตร์ได้พยายามจัดธาตุเหล่านี้ให้เป็นหมวดหมู่หรือเป็นตารางธาตุโดยในช่วงแรก ๆ นั้นแบ่งธาตุออกเป็นหมวดหมู่โดยอาศัยสมบัติของธาตุ ทั้งนี้ได้จากการสังเกตพบความคล้ายคลึงกันของสมบัติของธาตุเป็นกลุ่ม ๆ ทำให้นำมาจัดเป็นตารางธาตุได้ เช่นแบ่งกลุ่มโดยอาศัยสมบัติเกี่ยวกับโลหะ-อโลหะ โดยอาศัยสมบัติของความเป็นกรด-เบสของธาตุ เป็นต้น ต่อมาเมื่อหามวลอะตอมของธาตุได้ จึงใช้มวลอะตอมมาประกอบในการจัดตารางธาตุ จนในปัจจุบันจัดตารางธาตุโดยอาศัยการจัดเรียงอิเล็กตรอน
2.4.1 วิวัฒนาการของการสร้างตารางธาตุ
1. ตารางธาตุของเดอเบอไรเนอร์
การจัดตารางธาตุนั้นเริ่มขึ้นตั้งแต่ปี พ.ศ. 2360 (ค.ศ. 1817) โดย โยฮันน์ เดอเบอไรเนอร์ (Johaun Dobereiner) นักเคมีชาวเยอรมัน ได้นำธาตุต่าง ๆ ที่พบในขณะนั้นมาจัดเรียงเป็นตารางธาตุ โดยนำธาตุต่าง ๆ ที่มีสมบัติคล้ายคลึงกันมาจัดไว้ในหมู่เดียวกัน หมู่ละ 3 ธาตุ เรียงตามมวลอะตอมจากน้อยไปมากในแต่ละหมู่ มวลอะตอมของธาตุที่อยู่กลางจะเป็นค่าเฉลี่ยของมวลอะตอมของธาตุที่เหลืออีก 2 อะตอม เรียกว่า กฎชุดสาม (law of triads หรือ Dobereine’s law of triads)
ตารางที่ 8 มวลอะตอมเฉลี่ยของธาตุบางกลุ่มตามกฎชุดสาม
การจัดตารางธาตุนั้นเริ่มขึ้นตั้งแต่ปี พ.ศ. 2360 (ค.ศ. 1817) โดย โยฮันน์ เดอเบอไรเนอร์ (Johaun Dobereiner) นักเคมีชาวเยอรมัน ได้นำธาตุต่าง ๆ ที่พบในขณะนั้นมาจัดเรียงเป็นตารางธาตุ โดยนำธาตุต่าง ๆ ที่มีสมบัติคล้ายคลึงกันมาจัดไว้ในหมู่เดียวกัน หมู่ละ 3 ธาตุ เรียงตามมวลอะตอมจากน้อยไปมากในแต่ละหมู่ มวลอะตอมของธาตุที่อยู่กลางจะเป็นค่าเฉลี่ยของมวลอะตอมของธาตุที่เหลืออีก 2 อะตอม เรียกว่า กฎชุดสาม (law of triads หรือ Dobereine’s law of triads)
ตารางที่ 8 มวลอะตอมเฉลี่ยของธาตุบางกลุ่มตามกฎชุดสาม
ธาตุ
|
มวลอะตอม
|
มวลอะตอมของธาตุแถวที่ 1 และ 3
|
Li
Na
K
Cl
Br
I
|
6.940
22.997
39.096
35.453
79.909
126.197
|
23.018
81.197
|
จะเห็นได้ว่ามวลอะตอมเฉลี่ย มีค่าใกล้เคียงกับมวลอะตอมของธาตุกลาง อย่างไรก็ตาม เมื่อนำกฎดังกล่าวไปใช้กับธาตุกลุ่มอื่นที่มีสมบัติคล้ายคลึงกัน ปรากฏว่าไม่มีผลเท่าที่ควร มวลอะตอมของธาตุกลางไม่เท่ากับค่าเฉลี่ยของมวลอะตอมของธาตุที่เหลือ กฎชุดสามของเดอเบอไรเนอร์จึงไม่เป็นที่ยอมรับกันในเวลาต่อมา
2. ตารางธาตุของนิวแลนด์
ในปี พ.ศ. 2407 (ค.ศ. 1864) จอห์น นิวแลนด์ (John Newlands) นักเคมีชาวอังกฤษได้พบว่าเมื่อนำธาตุต่าง ๆ มาเรียงลำดับตามมวลอะตอมจากน้อยไปหามาก ให้เป็นแถวตามแนวนอน สมบัติของธาตุจะมีลักษณะคล้ายกันเป็นช่วง ๆ ซึ่งลักษณะดังกล่าวเกิดขึ้นทุก ๆ ของธาตุที่ 8 เช่น ถ้าเริ่มต้นจากธาตุ Li แล้วเรียงลำดับมวลอะตอมไปถึงธาตุที่ 8 จะตรงกับ Na ซึ่ง Li และ Na มีสมบัติต่าง ๆ คล้ายคลึงกัน
ตารางที่ 9 ตัวอย่างการจัดตารางธาตุของนิวแลนด์ส์
ในปี พ.ศ. 2407 (ค.ศ. 1864) จอห์น นิวแลนด์ (John Newlands) นักเคมีชาวอังกฤษได้พบว่าเมื่อนำธาตุต่าง ๆ มาเรียงลำดับตามมวลอะตอมจากน้อยไปหามาก ให้เป็นแถวตามแนวนอน สมบัติของธาตุจะมีลักษณะคล้ายกันเป็นช่วง ๆ ซึ่งลักษณะดังกล่าวเกิดขึ้นทุก ๆ ของธาตุที่ 8 เช่น ถ้าเริ่มต้นจากธาตุ Li แล้วเรียงลำดับมวลอะตอมไปถึงธาตุที่ 8 จะตรงกับ Na ซึ่ง Li และ Na มีสมบัติต่าง ๆ คล้ายคลึงกัน
ตารางที่ 9 ตัวอย่างการจัดตารางธาตุของนิวแลนด์ส์
H
|
Li
|
Be
|
B
|
C
|
N
|
O
|
F
|
Na
|
Mg
|
Al
|
Si
|
P
|
S
|
Cl
|
K
|
Ca
|
Cr
|
Ti
|
Mn
|
Fe
|
เรียกกฎการจัดตารางธาตุของนิวแลนด์ส์ว่า law of octaves หรือ Newlands’ law of octaves อย่างไรก็ตาม กฎนี้ไม่เป็นที่ยอมรับกัน เนื่องจากไม่สามารถอธิบายว่าเหตุใดมวลอะตอมจึงมาเกี่ยวข้องกับความคล้ายคลึงดังกล่าว นอกจากกฎนี้แล้วก็ยังใช้ได้กับ ธาตุที่มีมวลอะตอมต่ำ ๆ ไม่เกิน 20 ธาตุแรกเท่านั้น หลังจากนั้นจะใช้กฎนี้ไม่ได้
3. ตารางธาตุของเมนเดเลเอฟในระหว่างปี พ.ศ. 2412 - 2413 (ค.ศ. 1269 - 1270) ยูลิอุส ไมเออร์ (Julius Meyer) นักวิทยาศาสตร์ชาวเยอรมัน และดิมิทรี เมนเดเลเอฟ (Dimitri Mendelejev) นักวิทยาศาสตร์ชาวรัสเซียได้พบในเวลาใกล้เคียงกันว่าสมบัติต่าง ๆ ของธาตุมีส่วนสัมพันธ์กับมวลอะตอมของธาตุกล่าวคือ “ถ้าเรียงลำดับธาตุตามมวลอะตอมจากน้อยไปหามาก จะพบว่าธาตุ ๆ ต่าง จะมีสมบัติคล้ายคลึงกันเป็นช่วง ๆ ” ซึ่งเมเดเลเอฟได้ตั้งเป็นกฎเรียกว่า “กฎพิริออดิก” หรือกฎตารางธาตุ (Periodic law) และพิมพ์เผยแพร่ในปี พ.ศ. 2412 ก่อนที่ไมเออร์จะพิมพ์เผยแพร่ครั้งหนึ่ง ดังนั้นเพื่อเป็นเกียรติแก่เมนเดเลเอฟ จึงเรียกตารางนี้ว่า “ตารางพีริออดิกของเมนเดเลเอฟ” หรือตารางธาตุของเมนเดเลเอฟ (Mendelejev’ s periodic table)
เกณฑ์ที่สำคัญที่เมนเดเลเอฟใช้ คือ จัดธาตุที่มีสมบัติคล้ายคลึงกันที่ปรากฏซ้ำกันเป็นช่วง ๆ ให้อยู่ในหมู่หรือในแนวตั้งเดียวกัน และพยายามเรียงลำดับมวลอะตอมจากน้อยไปหามาก ในกรณีที่เรียงตามมวลอะตอมแล้วสมบัติของธาตุไม่สอดคล้องกัน ก็พยายามจัดให้เข้าหมู่โดยปล่อยให้ช่องว่างเว้นไว้ในตารางซึ่งเมนเดเลเอฟคิดว่า ช่องว่างเหล่านั้นน่าจะเป็นตำแหน่งของธาตุซึ่งยังไม่มีการค้นพบในขณะนั้น ในการจัดตารางธาตุนอกจากจะใช้มวลอะตอมแล้ว ยังใช้สมบัติทางเคมีและทางกายภาพของสารประกอบอื่น ๆ นอกเหนือจากสารประกอบคลอไรด์ และออกไซด์มาประกอบการพิจารณาด้วย

ตัวอย่างเช่น ธาตุที่อยู่ในช่องว่างใต้ Si เมนเดเลเอฟเรียกชื่อว่าธาตุเอคาซิลิคอน อีก 15 ปีต่อมาคือในปี พ.ศ. 2429 (ค.ศ. 1886) เคลเมนส์ วิงค์เลอร์ (Clemens Winkler) นักวิทยาศาสตร์ชาวเยอรมันจึงได้พบธาตุนี้และเรียกชื่อว่า ธาตุเจอร์เมเนียม (Ge) นั่นเอง
ตารางที่ 11 เปรียบเทียบสมบัติของธาตุเอคาซิลิคอนกับเจอร์เมเนียมที่ทำนายและที่ค้นพบ
สมบัติ
|
เอคาซิลิคอนทำนายเมื่อ พ.ศ. 2414 (ค.ศ. 1871)
|
เจอร์เมเนียมพบเมื่อ
พ.ศ. 2429 (ค.ศ.1886)
|
มวลอะตอม
สีของธาตุ
ความหนาแน่น (g/cm3)
จุดหลอมเหลว (0C )
สูตรของออกไซด์
ความหนาแน่นของออกไซด์ (g/cm3)
เมื่อผสมกับกรดไฮโดรคลอริก
|
72
เป็นโลหะสีเทา
5.5
สูง
GeO2
4.7
ละลายได้เล็กน้อย
|
72.6
เป็นโลหะสีเทา
5.36
958
GeO2
4.70
ไม่ละลายที่ 25 0C
|
ธาตุที่อยู่ใต้ B เรียกว่า เอคาโบรอน
ธาตุที่อยู่ใต้ Al เรียกว่า เอคาอะลูมิเนียม
ซึ่งปัจจุบันก็คือธาตุ Se และ Ga ตามลำดับ
การจัดตารางธาตุของเมนเดเลเอฟนั้น ถ้ายึดหลักการเรียงตามมวลอะตอมจากน้อยไปหามากอย่างเคร่งครัด จะทำให้ธาตุบางธาตุซึ่งมีสมบัติแตกต่างกันอยู่ในหมู่เดียวกัน ทำให้ต้องยกเว้นไม่เรียงตามมวลอะตอมบ้างแต่เมนเดเลเอฟก็ไม่สามารถให้เหตุผลได้ว่าเป็นเพราะเหตุใดจึงต้องเรียงลำดับธาตุเช่นนั้น เนื่องจากในขณะนั้นยังไม่มีความเข้าใจเกี่ยวกับโครงสร้างของอะตอมไม่มากพอ นักวิทยาศาสตร์ต่อ ๆ มาจึงสร้างแนวคิดใหม่ว่า ตำแหน่งของธาตุในตารางธาตุไม่ควรขึ้นอยู่กับมวลอะตอม แต่ควรจะขึ้นอยู่กับสมบัติอื่น ๆ ที่สัมพันธ์กับมวลอะตอ
4. ตารางธาตุของเฮนรี โมสลีย์ เฮนรี โมสลีย์ (Henry Moseley) นักวิทยาศาสตร์ชาวอังกฤษ ได้แก้ไขตารางธาตุของเมนเดเลเอฟให้ถูกต้องขึ้น โดยการพบว่าเลขอะตอม หรือจำนวนโปรตอนในนิวเคลียสของธาตุ มีความสัมพันธ์กับสมบัติของธาตุมากกว่ามวลอะตอม ทำให้สอดคล้องกับกฎพีริออดิกมากกว่า สามารถสร้างตารางธาตุได้โดยไม่ต้องสลับที่ธาตุบางธาตุเหมือนกรณีการจัดเรียงตามมวลอะตอม
ประมาณปี พ.ศ. 2456 (ค.ศ. 1913) โมสลีย์จึงเสนอตารางธาตุใหม่โดยเรียงตามเลขอะตอมจากน้อยไปหามาก และจัดธาตุที่มีสมบัติคล้ายคลึงกันให้อยู่ในหมู่เดียวกัน และกำหนดกฎตารางธาตุขึ้นใหม่เป็น “สมบัติต่าง ๆ ของธาตุในตารางธาตุขึ้นอยู่กับเลขอะตอมของธาตุ”
ตารางธาตุในปัจจุบัน
เนื่องจากปัจจุบันนักเคมีพบว่า การจัดเรียงตัวของอิเล็กตรอนในอะตอมของธาตุมีส่วนสัมพันธ์กับสมบัติต่าง ๆ ของธาตุ กล่าวคือ ถ้าเรียงลำดับธาตุตามเลขอะตอมจากน้อยไปหามาก จะพบว่าธาตุที่มีสมบัติคล้ายคลึงกันเป็นช่วง ๆ ตามลักษณะของการจัดเรียงอิเล็กตรอนในอะตอมของธาตุนั้น ดังนั้นในปัจจุบันจึงจัดตารางธาตุโดยเรียงตามเลขอะตอมจากน้อยไปมาก

1.ธาตุหมู่หลัก มีทั้งหมด 8 หมู่ 7 คาบ โดยธาตุที่อยู่ด้านซ้ายของเส้นขั้นบันได จะเป็นโลหะ (Metal) ส่วนทางด้านขวาเป็นอโลหะ (Non metal) ส่วนธาตุที่อยู่ติดกับเส้นขั้นบันไดนั้น จะเป็นกึ่งโลหะ (Metalloid)
2.ธาตุทรานซิชัน มีทั้งหมด 8 หมู่ แต่หมู่ 8 มีทั้งหมด 3 หมู่ย่อย จึงมีธาตุต่างๆ รวม 10 หมู่ และมีทั้งหมด 4 คาบ
3.ธาตุอินเนอร์ทรานซิชัน มี 2คาบโดยมีชื่อเฉพาะเรียกคาบแรกว่าคาบแลนทาไนด์
(Lanthanide series) และเรียกคาบที่สองว่า คาบแอกทิไนด์ (Actinide series) เพราะเป็นคาบที่อยู่ต่อมาจาก 57La (Lanthanum) และ 89Ac (Actinium) ตามลำดับ คาบละ 14 ตัวรวมเป็น 28
ตัว2.4.2กลุ่มของธาตุในตารางธาตุ
ประเภทของธาตุในตารางธาตุ
ธาตุโลหะ (metal) โลหะทรานซิชันเป็นต้นฉบับของโลหะ ธาตุโลหะเป็นธาตุที่มีสถานะเป็นของแข็ง ( ยกเว้นปรอท ที่เป็นของเหลว) มีผิวที่มันวาว นำความร้อน และไฟฟ้าได้ดี มีจุดเดือดและจุดหลอมเหลวสูง ( ช่วงอุณหภูมิระหว่างจุดหลอมเหลวกับจุดเดือดจะต่างกันมาก) ได้แก่ โซเดียม (Na) เหล็ก (Fe) แคลเซียม (Ca) ปรอท (Hg) อะลูมิเนียม (Al) แมกนีเซียม (Mg) สังกะสี (Zn) ดีบุก (Sn) เป็นต้น
ธาตุอโลหะ ( Non metal ) มีได้ทั้งสามสถานะ สมบัติส่วนใหญ่จะตรงข้ามกับอโลหะ เช่น ผิวไม่มันวาว ไม่นำไฟฟ้า ไม่นำความร้อน จุดเดือดและจุดหลอมเหลวต่ำ เป็นต้น ได้แก่ คาร์บอน( C ) ฟอสฟอรัส (P) กำมะถัน (S) โบรมีน (Br) ออกซิเจน (O 2) คลอรีน (Cl 2) ฟลูออรีน (F 2) เป็นต้น
ธาตุกึ่งโลหะ (metalloid) เป็นธาตุกึ่งตัวนำ คือ มันจะสามารถนำไฟฟ้าได้เฉพาะในภาวะหนึ่งเท่านั้น ธาตุกึ่งโลหะเหล่านี้จะอยู่บริเวณเส้นขั้นบันได ได้แก่ โบรอน (B) ซิลิคอน ( Si) เป็นต้น
ธาตุกัมมันตรังสี เป็นธาตุที่มีส่วนประกอบของ นิวตรอน กับโปรตอน ไม่เหมาะสม (>1.5) ธาตุที่ 83ขึ้นไปเป็นธาตุกัมมันตภาพรังสีทุกไอโซโทปมีครึ่งชีวิต
สมบัติของธาตุในแต่ละหมู่
ธาตุหมู่ I A หรือโลหะอัลคาไล (alkaline metal)
- โลหะอัลคาไล ได้แก่ ลิเทียม โซเดียม โพแทสเซียม รูบิเดียม ซีเซียม และแฟรนเซียม
- เป็นโลหะอ่อน ใช้มีดตัดได้
- เป็นหมู่โลหะมีความว่องไวต่อการเกิดปฏิกิริยามากที่สุด สามารถทำปฏิกิริยากับออกซิเจนในอากาศ จึงต้องเก็บไว้ในน้ำมัน
-ออกไซด์และไฮดรอกไซด์ของโลหะอัลคาไลละลายน้ำได้สารละลายเบสแก่
- เมื่อเป็นไอออน จะมีประจุบวก
- มีจุดเดือดและจุดหลอมเหลวต่ำ มีความหนาแน่นต่ำเมื่อเทียบกับโลหะอื่นๆ
- มีเวเลนซ์อิเล็กตรอน = 1
- เป็นโลหะอ่อน ใช้มีดตัดได้
- เป็นหมู่โลหะมีความว่องไวต่อการเกิดปฏิกิริยามากที่สุด สามารถทำปฏิกิริยากับออกซิเจนในอากาศ จึงต้องเก็บไว้ในน้ำมัน
-ออกไซด์และไฮดรอกไซด์ของโลหะอัลคาไลละลายน้ำได้สารละลายเบสแก่
- เมื่อเป็นไอออน จะมีประจุบวก
- มีจุดเดือดและจุดหลอมเหลวต่ำ มีความหนาแน่นต่ำเมื่อเทียบกับโลหะอื่นๆ
- มีเวเลนซ์อิเล็กตรอน = 1
ธาตุหมู่ II A หรือโลหะอัลคาไลน์เอิร์ธ (alkaline earth)
- โลหะอัลคาไลน์เอิร์ธ ได้แก่ เบริลเลียม แมกนีเซียม แคลเซียม สตรอนเชียม แบเรียม เรเดียม
- มีความว่องไวต่อการเกิดปฏิกิริยามาก แต่น้อยกว่าโลหะอัลคาไล
- ทำปฏิกิริยากับน้ำได้สารละลายเบส สารประกอบโลหะอัลคาไลน์เอิร์ธพบมากในธรรมชาติ
- โลหะอัลคาไลน์เอิร์ธมีความว่องไวแต่ยังน้อยกว่าโลหะอัลคาไล
- โลหะอัลคาไลน์เอิร์ธมีเวเลนซ์อิเล็กตรอน = 2
- มีความว่องไวต่อการเกิดปฏิกิริยามาก แต่น้อยกว่าโลหะอัลคาไล
- ทำปฏิกิริยากับน้ำได้สารละลายเบส สารประกอบโลหะอัลคาไลน์เอิร์ธพบมากในธรรมชาติ
- โลหะอัลคาไลน์เอิร์ธมีความว่องไวแต่ยังน้อยกว่าโลหะอัลคาไล
- โลหะอัลคาไลน์เอิร์ธมีเวเลนซ์อิเล็กตรอน = 2
ธาตุหมู่ III
- ธาตุหมู่ III ได้แก่ B Al Ga In Tl
- มีเวเลนซ์อิเล็กตรอน = 3
- ธาตุหมู่ III ได้แก่ B Al Ga In Tl
- มีเวเลนซ์อิเล็กตรอน = 3
ธาตุหมู่ IV
- ธาตุหมู่ IV ได้แก่ C Si Ge Sn Pb
- มีเวเลนซ์อิเล็กตรอน = 4
- ธาตุหมู่ IV ได้แก่ C Si Ge Sn Pb
- มีเวเลนซ์อิเล็กตรอน = 4
ธาตุหมู่ V
- ธาตุหมู่ V ได้แก่ N P As Sb Bi
- มีเวเลนซ์อิเล็กตรอน = 5
- ธาตุหมู่ V ได้แก่ N P As Sb Bi
- มีเวเลนซ์อิเล็กตรอน = 5
ธาตุหมู่ VI
- ธาตุหมู่ VI ได้แก่ O S Se Te Po
- มีเวเลนซ์อิเล็กตรอน = 6
- ธาตุหมู่ VI ได้แก่ O S Se Te Po
- มีเวเลนซ์อิเล็กตรอน = 6
ธาตุหมู่ VII หรือหมู่แฮโลเจน (Halogen group)
- หมู่ธาตุแฮโลเจน ได้แก่ ฟลูออรีน คลอรีน โบรมีน ไอโอดีน และแอสทาทีน
- เป็นหมู่อโลหะที่ว่องไวต่อการเกิดปฏิกิริยามากที่สุด (F ว่องไวต่อการเกิดปฏิกิริยามากที่สุด)
- เป็นธาตุที่มีพิษทุกธาตุและมีกลิ่นแรง
- โมเลกุลของธาตุแฮโลเจนประกอบด้วย 2 อะตอม (Cl 2 Br 2 I 2)
- แฮโลเจนไอออนมีประจุบลบหนึ่ง (F - C - Br - I - At -)
- เป็นหมู่อโลหะที่ว่องไวต่อการเกิดปฏิกิริยามากที่สุด (F ว่องไวต่อการเกิดปฏิกิริยามากที่สุด)
- เป็นธาตุที่มีพิษทุกธาตุและมีกลิ่นแรง
- โมเลกุลของธาตุแฮโลเจนประกอบด้วย 2 อะตอม (Cl 2 Br 2 I 2)
- แฮโลเจนไอออนมีประจุบลบหนึ่ง (F - C - Br - I - At -)
ธาตุหมู่ VIII หรือก๊าซเฉื่อย หรือก๊าซมีตระกูล (Inert gas )
- ก๊าซมีตระกูล ได้แก่ ฮีเลียม นีออน อาร์กอน คริปทอน ซีนอน และเรดอน
- มีเวเลนซ์อิเล็กตรอนเต็ม 8 อิเล็กตรอน จึงทำให้เป็นก๊าซที่ไม่ว่องไวต่อการเกิดปฏิกิริยา
- ก๊าซมีตระกูลอยู่เป็นอะตอมเดี่ยว แต่ยกเว้น Kr กับ Xe ที่สามารถสร้างพันธะได้
- มีเวเลนซ์อิเล็กตรอนเต็ม 8 อิเล็กตรอน จึงทำให้เป็นก๊าซที่ไม่ว่องไวต่อการเกิดปฏิกิริยา
- ก๊าซมีตระกูลอยู่เป็นอะตอมเดี่ยว แต่ยกเว้น Kr กับ Xe ที่สามารถสร้างพันธะได้
2.4.3 ขนาดของอะตอม
เส้นผ่านศูนย์กลางการโคจรของอิเล็กตรอนทำนายได้โดยประจุของนิวเคลียส ตัวอย่างเช่น ประจุบวกของโปรตอน 1 ตัวในนิวเคลียสของธาตุไฮโดรเจน ดึงดูดอิเล็กตรอนไว้หนึ่งตัว ถ้านิวเคลียสมีขนาดใหญ่มากขึ้นก็จะดึงดูดอิเล็กตรอนให้เข้ามาใกล้นิวเคลียสมากขึ้นตัวอย่างเช่นไฮโดรเจนมีโปรตอน 1 ตัว ขนาดของไฮโดรเจนใหญ่กว่าฮีเลียมเพราะฮีเลียมมีโปรตอน 2 ตัวดึงดูดอิเล็กตรอนให้มาอยู่ชิดนิวเคลียสได้มากกว่า
- ธาตุในคาบเดียวกัน ขนาดของอะตอมเล็กลงจากซ้ายไปขวา เพราะประจุนิวเคลียสสุทธิเพิ่มขึ้น จึงดึงดูดเวเลนซ์อิเล็กตรอนมากขึ้น ขนาดอะตอมจึงเล็กลง ในขณะที่เลขควอนตัมหลักของเวเลนซ์อิเล็กตรอนคงที่ ยกตัวอย่างเช่น ธาตุในคาบที่ 2 ขนาดอะตอม Li > Be > B > C > N > O > F
แต่ถ้าเพิ่มระดับชั้นพลังงานขึ้นมาเช่น ในคาบ 2 มี 2 ระดับชั้น คาบ 3 มี 3 ระดับชั้นอะตอมคาบล่างๆมีขนาดใหญ่ขึ้น เพราะในระดับชั้นแรกๆใกล้นิวเคลียสจะอยู่ชิดนิวเคลียสแต่ในระดับชั้นนอกๆจะอยู่ห่างนิวเคลียสมากเมื่อนิวเคลียสมีมวลมากขึ้นระดับชั้นพลังงานมากขึ้นทำให้มันใหญ่ขึ้น และในขณะเดียวกันมันก็มีแรงดึงดูดอิเล็กตรอนให้เข้ามาใกล้ตัวเองมากขึ้นเช่นกันทำให้อะตอมมีขนาดเล็กลง ดังนั้นอะตอมที่มีน้ำหนักตางกันมากๆจึงมีขนาดใกล้เคียงกัน ภาพจำลองขนาดของอะตอมมีขนาดใกล้เคียงกัน
ขนาดของอะตอม วัดจากระยะห่างระหว่างนิวเคลียสของอะตอมที่อยู่ติดกัน สำหรับธาตุที่อยู่ในลักษณะโมเลกุลอะตอมคู่ รัศมีอะตอมจะถือว่าเป็นครึ่งหนึ่งของระยะระหว่างนิวเคลียสของ 2 อะตอมในโมเลกุล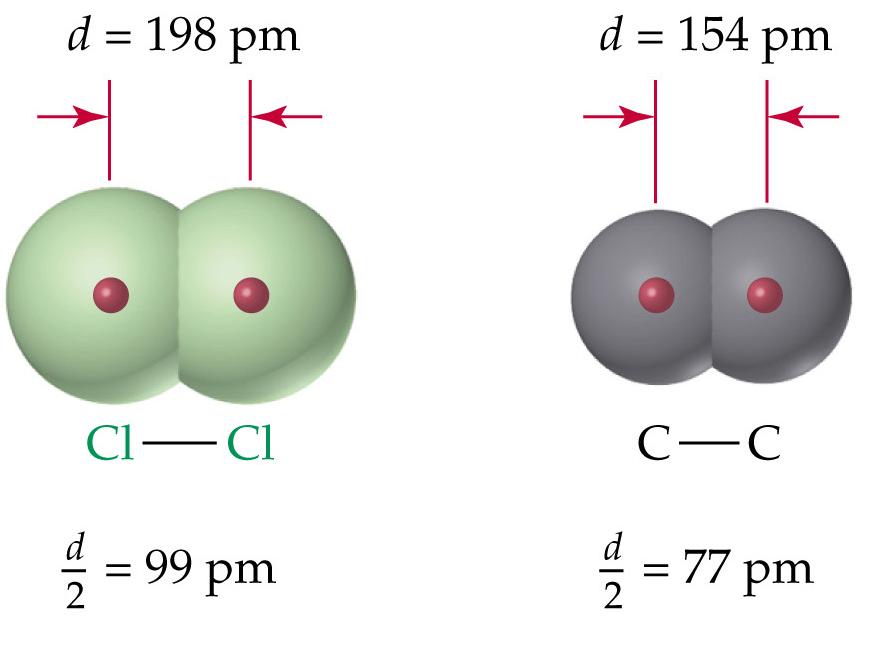 |
| จากรูป ระยะห่างระหว่างอะตอมของคลอรีนเท่ากับ 99 พิโคเมตร ส่วนคาร์บอนเท่ากับ 77 พิโคเมตร |
ปัจจัยที่มีผลต่อขนาดอะตอม
1. เลขควอนตัมหลัก(n)ของเวเลนซ์อิเล็กตรอน 2. ประจุนิวเคลียสสุทธิ(effective nuclear charge;Zeff) - ธาตุในหมู่เดียวกัน ขนาดของอะตอมใหญ่ขึ้นจากบนลงล่าง เพราะธาตุที่อยู่ด้านล่างมีเลขควอนตัมหลักของเวเลนซ์อิเล็กตรอนมาก หรืออาจกล่าวว่า ขนาดของอะตอมมีขนาดใหญ่ขึ้นตามเลขควอนตัมหลักที่เพิ่มขึ้น ยกตัวอย่างเช่น ธาตุในหมู่ IA ขนาดอะตอม Li < Na < K < Rb < Cs- ธาตุในคาบเดียวกัน ขนาดของอะตอมเล็กลงจากซ้ายไปขวา เพราะประจุนิวเคลียสสุทธิเพิ่มขึ้น จึงดึงดูดเวเลนซ์อิเล็กตรอนมากขึ้น ขนาดอะตอมจึงเล็กลง ในขณะที่เลขควอนตัมหลักของเวเลนซ์อิเล็กตรอนคงที่ ยกตัวอย่างเช่น ธาตุในคาบที่ 2 ขนาดอะตอม Li > Be > B > C > N > O > F
 |
| ขนาดอะตอมจะลดลงจากซ้ายไปขวาของตารางธาตุ |
2.4.4ขนาดไอออน
รัศมีไอออน
อะตอมซึ่งมีจำนวนโปรตอนเท่ากับอิเล็กตรอน เมื่อรับอิเล็กตรอนเพิ่มเข้ามาหรือเสียอิเล็กตรอนออกไปอะตอมจะกลายเป็นไอออน นักเรียนคิดว่าขนาดของไอออนกับขนาดอะตอมของธาตุเดียวกันจะแตกต่างกันหรือไม่
การบอกขนาดของไอออนทำได้เช่นเดียวกับการบอกขนาดอะตอม กล่าวคือจะบอกเป็นค่ารัศมีไอออน ซึ่งพิจารณาจากระยะระหว่างนิวเคลียสของไอออนคู่หนึ่งๆ ที่มีแรงยึดเหนี่ยวซึ่งกันและกันในโครงผนึก ตัวอย่างรัศมีไอออนของ และ ในสารประกอบ MgO แสดงดังรูป



ขนาดของ Mg กับ และ O กับ แตกต่างกันอย่างไร เพราะเหตุใด
เมื่อโลหะทำปฏิกิริยากับอโลหะ อะตอมของโลหะจะเสียเวเลนซ์อิเล็กตรอนกลายเป็นไอออนบวก จำนวนอิเล็กตรอนในอะตอมจึงลดลง ทำให้แรงผลักระหว่างอิเล็กตรอนลดลงด้วย หรือกล่าวอีกนัยหนึ่งได้ว่าแรงดึงดูดระหว่างประจุในนิวเคลียสกับอิเล็กตรอน จะเพิ่มมากขึ้นไอออนบวกจึงมีขนาดเล็กกว่าอะตอมเดิม ส่วนอะตอมของอโลหะนั้นส่วนใหญ่จะรับอิเล็กตรอนเพิ่มเข้ามาและเกิดเป็นไอออน ลบ เนื่องจากมีการเพิ่มขึ้นของจำนวนอิเล็กตรอนจึงทำให้แรงผลักระหว่าง อิเล็กตรอนที่เคลื่อนที่อยู่รอบนิวเคลียสมีค่าสูงขึ้น ขอบเขตของกลุ่มหมอกอิเล็กตรอนจะขยายออกไปจากเดิม ไอออนลบจึงมีมีขนาดใหญ่กว่าอะตอมเดิม ตัวอย่างขนาดอะตอมกับขนาดไอออนของธาตุแสดงดังรูป

รัศมีอะตอมและรัศมีไอออน (พิโกเมตร) ของธาตุบางชนิด
เมื่อพิจารณาแนวโน้มของรัศมีอะตอมและรัศมีไอออนตามหมู่ จะพบว่าหมู่ IA IIA IIIA และ VIIA มีแนวโน้มเช่นเดียวกันคืออะตอมและไอออนมีขนาดเพิ่มขึ้นจากบนลงล่าง รัศมีไอออนบวกจะมีค่าน้อยกว่ารัศมีอะตอมแต่รัศมีไอออนลบจะมีค่ามากกว่ารัศมี อะตอมการเปรียบเทียบขนาดไอออนที่มีความหมาย จะเปรียบเทียบระหว่างไอออนที่มีการจัดอิเล็กตรอนเหมือนกันหรือมีจำนวน อิเล็กตรอนเท่ากัน เช่น กับ ซึ่งมี 10 อิเล็กตรอนเท่ากันและจัดอิเล็กตรอนเป็น พบว่า มีขนาดไอออนเล็กกว่า ทั้งนี้เพราะ มีประจุในนิวเคลียสมากกว่า ส่วนไอออนบวกที่จัดอิเล็กตรอนเหมือนกัน ไอออนบวกที่มีประจุมากจะมีขนาดเล็กกว่าไอออนบวกที่มีประจุน้อย นั่นคือไอออน 3+ จะมีขนาดเล็กกว่า 2+ และ 1+ ตามลำดับ
2.4.5พลังงานไอออไนเซชัน
พลังงานไอออไนเซชัน คือ พลังงานที่ใช้ในการทำให้อิเล็กตรอนหลุดออก จากอะตอมของธาตุในสภาพวะของธาตุในสภาพวะก๊าซ- ธาตุในหมู่เดียวกัน ค่า IE1 จะลดลง เมื่อเลขอะตอมเพิ่มขึ้นระดับพลังงานของ เวเลนซ์อิเล็กตรอนเพิ่มขึ้น ซึ่งเป็นการเพิ่มระยะห่างระหว่างอิเล็กตรอนกับนิวเคลียส ทำให้แรงดึงดูดระหว่างนิวเคลียสกับอิเล็กตรอนลดลง IE1 จึงมีค่าน้อย( อิเล็กตรอนหลุดได้ง่าย )
- ธาตุในคาบเดียวกัน ค่า IE1 จะเพิ่มขึ้นเมื่อเลขอะตอมเพิ่มขึ้น เนื่องจากขนาด ของอะตอมจะเล็กลงตามคาบ แรงดึงดูดระหว่างนิวเคลียสกับอิเล็กตรอนมีค่าเพิ่มขึ้น จึงต้องใช้พลังสูงขึ้นในการดึงอิเล็กตรอน ( IE1 มีค่าเพิ่มขึ้น )
- เมื่อให้พลังงานแก่อะตอมของธาตุในสถานะของเหลวหรือของแข็งในปริมาณที่มากพอจะทำให้อะตอมเปลี่ยนสถานะเป็นแก็สได้ และถ้าใหพลังงานต่อไปอีกจนสูงเพียงพอก็จะทำให้อิเล็กตรอนหลุดออกจากอะตอมกลายเป็นไอออน
พลังงานไอออไนเซชัน หรือ IE คือ พลังงานปริมาณน้อยที่สุดที่สามารถดึงอิเล็กตรอนหลุดออกจากอะตอมในสถานะแก็ว เช่น การทำให้ไฮโดรเจนไอออนในสถานะแก็ส การทำให้อิเล็กตรอนหลุดออกจากอะตอมของ H จะต้องใช้พลังงานอย่างน้อย 2.19 x 10-18 J ต่อ อะตอม หรือ 1318 กิโลจูลต่อโมล
พลังงานไอออไนเซชัน (Ionization Energy, IE) คือค่าพลังงาน ที่ใช้ในการดึงให้อิเล็กตรอนวงนอกสุด (เวเลนซ์อิเล็กตรอน) หลุดออกจากอะตอมที่อยู่ในสถานะก๊าซ โดยอะตอมของแต่ละธาตุจะมีค่าพลังงานไอออไนเซชันแตกต่างกันไป แต่ละอะตอมมีค่าพลังงานนี้ได้หลายค่า เรียกเป็น IE1 IE2 IE3 ... ซึ่งก็คือค่าพลังงานในการดึงอิเล็กตรอนตัวที่ 1 2 3 ... นั่นเอง โดยยิ่งดึงอิเล็กตรอนที่ทมีลำดับมากขึ้น ก็จะต้องใช้พลังงานสูงขึ้นด้วย

แนวโน้มค่าพลังงานไอออไนเซชันตามหมู่
ตามหมู่ ค่าพลังงานไอออไนเซชันลำดับที่ 1 ของธาตุในหมู่เดียวกันมีแนวโน้มลดลงจากบนลงล่างของตารางธาตุ เนื่องจากธาตุในหมู่เดียวกันเมื่อเลขอะตอมเพิ่มขึ้นอะตอมจะมีขนาดใหญ่ขึ้น ระดับพลังงานของเวเลนซ์อิเล็กตรอนสูงขึ้น เวเลนซ์อิเล็กตรอนจึงอยู่ห่างนิวเคลียสมากขึ้น ทำให้แรงดึงดูดระหว่างนิวเคลียสกับเวเลนซ์อิเล็กตรอนลดลงอิเล็กตรอน จึงหลุดออกจากอะตอมได้ง่ายค่าพลังงานไอออไนเซชันจึงลดลง
ตามหมู่ ค่าพลังงานไอออไนเซชันลำดับที่ 1 ของธาตุในหมู่เดียวกันมีแนวโน้มลดลงจากบนลงล่างของตารางธาตุ เนื่องจากธาตุในหมู่เดียวกันเมื่อเลขอะตอมเพิ่มขึ้นอะตอมจะมีขนาดใหญ่ขึ้น ระดับพลังงานของเวเลนซ์อิเล็กตรอนสูงขึ้น เวเลนซ์อิเล็กตรอนจึงอยู่ห่างนิวเคลียสมากขึ้น ทำให้แรงดึงดูดระหว่างนิวเคลียสกับเวเลนซ์อิเล็กตรอนลดลงอิเล็กตรอน จึงหลุดออกจากอะตอมได้ง่ายค่าพลังงานไอออไนเซชันจึงลดลง
แนวโน้มค่าพลังงานไอออไนเซชันตามคาบ
แนวโน้มค่าพลังงานไอออไนเซชันตามคาบค่าพลังงานไอออไนเซชันลำดับที่ 1 ของธาตุในคาบเดียวกันมีแนวโน้มเพิ่มขึ้นตามเลขอะตอมจากซ้ายไปขวาของตารางธาตุ เนื่องจากธาตุในคาบเดียวกันมีขนาดอะตอมลดลงตามคาบ แรงดึงดูดระหว่างนิวเคลียสกับเวเลนซ์อิเล็กตรอนมีค่าเพิ่มขึ้นเป็นผลให้อิเล็กตรอนหลุดออกจากอะตอมได้ยากขึ้น ค่าพลังงานไอออไนเซชันจึงสูงขึ้นด้วย
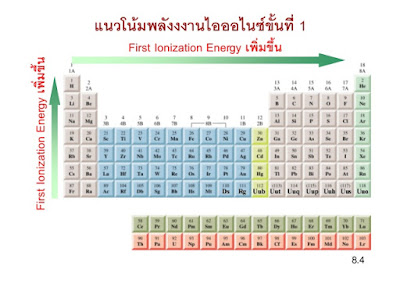
แนวโน้มค่าพลังงานไอออไนเซชันตามคาบค่าพลังงานไอออไนเซชันลำดับที่ 1 ของธาตุในคาบเดียวกันมีแนวโน้มเพิ่มขึ้นตามเลขอะตอมจากซ้ายไปขวาของตารางธาตุ เนื่องจากธาตุในคาบเดียวกันมีขนาดอะตอมลดลงตามคาบ แรงดึงดูดระหว่างนิวเคลียสกับเวเลนซ์อิเล็กตรอนมีค่าเพิ่มขึ้นเป็นผลให้อิเล็กตรอนหลุดออกจากอะตอมได้ยากขึ้น ค่าพลังงานไอออไนเซชันจึงสูงขึ้นด้วย

สรุป
ปัจจัยที่มีผลต่อแนวโน้มของค่าพลังงานไอออไนเซชันตามคาบก็คือเลขอะตอมหรือจำนวนโปรตอนในนิวเคลียส
4.4.6 สัมพรรคภาพอิเล็กตรอน
สัมพรรคภาพอิเล็กตรอน (electron affinity : EA) หมายถึงพลังงานที่อะตอมในสถานะแก๊สคายออกเมื่ออะตอมได้รับอิเล็กตรอน 1 อิเล็กตรอน ซึ่งเขียนสมการแสดงการเปลี่ยนแปลงพลังงานได้ดังนี้A(g) + e– A–(g) + DE
EA มีค่าเป็นลบ (–) เนื่องจากมีการคายพลังงานออกมา แสดงว่าอะตอมนั้นมีแนวโน้มที่จะรับอิเล็กตรอนเข้ามาได้ดี ความสามารถในการรับอิเล็กตรอนของแต่ละธาตุมีความแตกต่างกัน ดังตัวอย่าง
F(g) + e– F– (g) EA = –333 kJ/mol
O(g) + e– O– (g) EA = –142 kJ/mol
P(g) + e– P– (g) EA = –74 kJ/mol
จากตัวอย่างแสดงว่า F มีแนวโน้มรับอิเล็กตรอนได้สูงกว่า O และ P ตามลำดับ เมื่ออะตอมของธาตุรับ 1 อิเล็กตรอนแล้ว การรับอิเล็กตรอนเพิ่มขึ้นอีก 1 อิเล็กตรอนจะรับได้ยากขึ้น ดังนั้นค่า EAจึงมีค่าสูงขึ้นจนเป็นบวกได้ เช่น
O–(g) + e– O2–(g) EA = 780 kJ/mol
โลหะมีแนวโน้มที่จะเสียอิเล็กตรอน โดยทั่วไปค่า EA ของโลหะจึงมีค่าเป็นลบน้อย ๆ ถึงค่าบวกน้อย ๆ ดังตาราง
 |
| ตารางแสดงค่าสัมพรรคภาพอิเล็กตรอน |
สรุปแนวโน้มสัมพรรคภาพอิเล็กตรอน
1. เมื่อพิจารณาตามคาบ ค่า EA ในหมู่ IA IIA และ IIIA มีค่าเป็นลบน้อยกว่าธาตุที่อยู่ทางขวามือ แสดงว่าธาตุในหมู่ดังกล่าวมีแนวโน้มที่จะรับอิเล็กตรอนได้น้อยมาก โดยเฉพาะธาตุในหมู่ IIA มีค่า EA สูงที่สุด แสดงว่ารับอิเล็กตรอนยากที่สุด2. ธาตุหมู่ IVA VA VIA และ VIIA มีแนวโน้มสูงที่จะรับอิเล็กตรอน โดยเฉพาะธาตุหมู่ VIIA ชอบที่จะรับอิเล็กตรอนสูงที่สุด การรับอิเล็กตรอนของธาตุในหมู่ VIIA จะทำให้อะตอมมีการจัดเรียงอิเล็กตรอนเหมือนแก๊สเฉื่อยซึ่งมีความเสถียรมาก EA ของแก๊สเฉื่อยจึงมีค่าเป็นบวก
2.4.7 อิเล็กโทรเนกาติวิตี
อิเล็กโทรเนกาติวิตี (Electronegativity : EN)อิเล็กโทรเนกาติวิตี (electronegativity : EN) หมายถึงค่าที่แสดงความสามารถในการดึงดูดอิเล็กตรอนของอะตอมคู่ที่เกิดพันธะที่จะรวมกันเป็นโมเลกุล ธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูงจะมีความสามารถในการดึงดูดหรือรับอิเล็กตรอนได้ดี ได้แก่พวกอโลหะ ส่วนธาตุที่มีค่าอิเล็กโทรเนกาติวิตีต่ำจะดึงดูดหรือรับอิเล็กตรอนได้ไม่ดี ได้แก่พวกโลหะ เช่น โมเลกุลของ HCl เนื่องจาก Clดึงดูดอิเล็กตรอนได้ดีกว่า H ดังนั้น Cl จึงมีค่าอิเล็กโทรเนกาติวิตีสูงกว่า H แนวโน้มค่าอิเล็กโทรเนกาติวิตีของธาตุในตารางธาตุเป็นดังนี้
สรุปแนวโน้มค่าอิเล็กโทรเนกาติวิตี
1. แนวโน้มค่าอิเล็กโทรเนกาติวิตีตามคาบปัจจัยที่มีผลคือเลขอะตอมหรือประจุบวกในนิวเคลียส ธาตุที่มีประจุบวกในนิวเคลียสมากจะมีค่า EN สูง ดังนั้นธาตุที่อยู่ในคาบเดียวกันจะมีค่า EN ดังนั้นธาตุที่อยู่ในคาบเดียวกันจะมีค่า EN เพิ่มขึ้นจากซ้ายไปขวา เพราะประจุบวกที่นิวเคลียสจะส่งแรงดึงดูดกระทำต่ออิเล็กตรอนได้มาก
2. แนวโน้มค่าอิเล็กโทรเนกาติวิตีตามหมู่
ปัจจัยที่มีผลคือขนาดอะตอมซึ่งเป็นผลมาจากจำนวนระดับพลังงาน ธาตุที่มีจำนวนระดับพลังงานน้อย หรือขนาดอะตอมเล็ก จะมีค่า EN สูงกว่าธาตุที่มีขนาดอะตอมใหญ่ในหมู่เดียวกัน เพราะอะตอมที่มีขนาดใหญ่นิวเคลียสจะส่งแรงดึงดูดออกไปที่เวเลนซ์อิเล็กตรอนได้น้อย ดังนั้น “ธาตุที่อยู่ในหมู่เดียวกันจะมีค่า EN ลดลงจากบนลงล่าง”
2.5 ธาตุแทรนซิชัน
ธาตุแทรนซิชัน (transition elements) ตามความหมายเดิม หมายถึง ธาตุที่เมื่ออยู่ในสภาพที่ไม่ว่าจะเป็นธาตุอิสระ หรือเป็นองค์ประกอบของสารประกอบ มีอิเล็กตรอนอยู่ไม่เต็มในระดับพลังงานย่อย d หรือ fธาตุแทรนซิชันตามความหมายใหม่ หมายถึง ธาตุที่ไอออนของมันอย่างน้อย 1 ไอออนมีอิเล็กตรอนในระดับพลังงานย่อย d ไม่ครบ
ถ้าจะถือว่าทุกธาตุที่อยู่ในหมู่ย่อย B เป็นธาตุแทรนซิชัน ก็พบว่ามีบางธาตุที่ไม่ได้เป็นไปตามนิยามใหม่ ธาตุเหล่านี้ได้แก่ Se และ Zn เป็นต้น ซึ่งมีโครงแบบอิเล็กตรอน ดังนี้
(10).jpg)
2.5.1 สมบัติของธาตุแทรนซิชัน
นักเคมีจัดธาตุแทรนซิชันไว้ในกลุ่มของธาตุที่เป็นโลหะ แต่ไม่ได้เป็นกลุ่มเดียวกับธาตุหมู่ IA IIA และ IIIA เพราะเหตุใดจึงจัดธาตุแทรนซิชันไว้อีกกลุ่มหนึ่ง เพื่อตอบคำถามนี้ให้ศึกษาสมบัติของธาตุแทรนซิชันเปรียบเทียบกับสมบัติของธาตุหมู่ IA และ IIA ที่อยู่ในคาบเดียวกัน
 |
| สมบัติบางประการของโพแทสเซียม แคลเซียม และธาตุแทรนซิชันในคาบที่ 4 |
พบว่าธาตุแทรนซิชันในคาบที่ 4 มีสมบัติหลายประการคล้ายกับโลหะโพแทสเซียมและแคลเซียม เช่น พลังงานไอออไนเซชันลำดับที่ 1 และอิเล็กโทรเนกาติวิตีมีค่าต่ำ แต่จุดหลอมเหลว จุดเดือด และความหนาแน่นมีค่าสูง และสูงมากกว่าหมู่ IA และหมู่ IIA ธาตุเทรนซิชัน จึงควรเป็นโลหะ แต่ธาตุแทรนซิชันในคาบที่ 4 มีสมบัติบางประการที่แตกต่างจากโลหะโพแทสเซียมและแคลเซียมคือ มีขนาดอะตอมใกล้เคียงกันภายในกลุ่มของธาตุแทรนซิชันเอง แต่มีขนาดเล็กกว่าโลหะโพแทสเซียมและแคลเซียม นักเรียนคิดว่าเพราะเหตุใดจึงเป็นเช่นนั้น ให้พิจารณาการจัดเรียงอิเล็กตรอนของธาตุโพแทสเซียมแคลเซียมและธาตุแทรนซิชันในคาบที่ 4
.jpg) |
| การจัดเรียงอิเล็กตรอนของธาตุโพแทสเซียม แคลเซียม และธาตุแทรนซิชันในคาบที่ 4 * [Ar] แทนการจัดเรียงอิเล็กตรอนของธาตุอาร์กอน |
- ธาตุแทรนซิชันในคาบที่ 4 มีการบรรจุอิเล็กตรอนในระดับพลังงานย่อยใด มีจำนวนเวเลนซ์อิเล็กตรอนเท่าใด
จะเห็นได้ว่าธาตุแทรนซิชันในคาบที่ 4 ส่วนใหญ่มีจำนวนเวเลนซ์อิเล็กตรอนเป็น 2 และมีจำนวนอิเล็กตรอนในระดับพลังงานย่อยที่อยู่ถัดจากระดับพลังงานนอกสุดเข้าไปไม่เท่ากัน เนื่องจากอิเล็กตรอนตัวสุดท้ายบรรจุอยู่ในระดับพลังงานย่อย 3d เช่น ธาตุ Sc มีจำนวนอิเล็กตรอนใน 3d เป็น 1 ธาตุ Ti ซึ่งอยู่ในลำดับถัดไปมีอิเล็กตรอนใน 3d เป็น 2 และเพิ่มขึ้นจนครบ 10 ในธาตุ Cu การที่มีอิเล็กตรอนเพิ่มขึ้นในออร์บิทัล 3d ซึ่งเป็นอิเล็กตรอนวงในที่สามารถกำบังแรงดึงดูดจากนิวเคลียสที่มีต่ออิเล็กตรอนในออร์บิทัล 4s ได้มากแม้ว่าประจุในนิวเคลียสจะเพิ่มขึ้น ขนาดอะตอมของธาตุแทรนซิชันคาบที่ 4 จากซ้ายไปขวาจะมีขนาดลดลงเล็กน้อยและไม่แตกต่างกันอย่างชัดเจนเหมือนธาตุโพแทสเซียมและแคลเซียม
2.5.2 สารประกอบของธาตุแทรนซิชัน
สารเคมีที่ได้ศึกษามาแล้ว เช่น และ
และ เป็นสารประกอบของธาตุแทรนซิชัน สารประกอบของธาตุในกลุ่มนี้แตกต่างจากสารประกอบของโลหะในกลุ่ม A อย่างไร นักเรียนจะได้ศึกษาสมบัติของสารประกอบของโครเมียมและแมงกานีส เพื่อเป็นแนวทางในการศึกษาสมบัติของธาตุแทรนซิชันอื่นๆ ต่อไป
เป็นสารประกอบของธาตุแทรนซิชัน สารประกอบของธาตุในกลุ่มนี้แตกต่างจากสารประกอบของโลหะในกลุ่ม A อย่างไร นักเรียนจะได้ศึกษาสมบัติของสารประกอบของโครเมียมและแมงกานีส เพื่อเป็นแนวทางในการศึกษาสมบัติของธาตุแทรนซิชันอื่นๆ ต่อไป
 และ
และ เป็นสารประกอบของธาตุแทรนซิชัน สารประกอบของธาตุในกลุ่มนี้แตกต่างจากสารประกอบของโลหะในกลุ่ม A อย่างไร นักเรียนจะได้ศึกษาสมบัติของสารประกอบของโครเมียมและแมงกานีส เพื่อเป็นแนวทางในการศึกษาสมบัติของธาตุแทรนซิชันอื่นๆ ต่อไป
เป็นสารประกอบของธาตุแทรนซิชัน สารประกอบของธาตุในกลุ่มนี้แตกต่างจากสารประกอบของโลหะในกลุ่ม A อย่างไร นักเรียนจะได้ศึกษาสมบัติของสารประกอบของโครเมียมและแมงกานีส เพื่อเป็นแนวทางในการศึกษาสมบัติของธาตุแทรนซิชันอื่นๆ ต่อไป
การศึกษาสมบัติของสารประกอบของโครเมียมและแมงกานีส
ตอนที่ 1 สารประกอบของโครเมียม
1. ใส่สารละลาย 0.1 mol/
0.1 mol/ จำนวน0.5
จำนวน0.5  ลงในหลอดทดลองขนาดเล็ก
ลงในหลอดทดลองขนาดเล็ก
2. เติมสารละลาย 1 mol/
1 mol/ จำนวน0.5
จำนวน0.5  เขย่า สังเกตสีของสารละลาย
เขย่า สังเกตสีของสารละลาย
3. เติมสารละลาย เข้มข้นร้อยละ 6 โดยปริมาตร จำนวน 0.5 mol/
เข้มข้นร้อยละ 6 โดยปริมาตร จำนวน 0.5 mol/ เขย่า สังเกตการเปลี่ยนแปลง
เขย่า สังเกตการเปลี่ยนแปลง
ตอนที่ 1 สารประกอบของโครเมียม
1. ใส่สารละลาย
 0.1 mol/
0.1 mol/ จำนวน0.5
จำนวน0.5  ลงในหลอดทดลองขนาดเล็ก
ลงในหลอดทดลองขนาดเล็ก2. เติมสารละลาย
 1 mol/
1 mol/ จำนวน0.5
จำนวน0.5  เขย่า สังเกตสีของสารละลาย
เขย่า สังเกตสีของสารละลาย3. เติมสารละลาย
 เข้มข้นร้อยละ 6 โดยปริมาตร จำนวน 0.5 mol/
เข้มข้นร้อยละ 6 โดยปริมาตร จำนวน 0.5 mol/ เขย่า สังเกตการเปลี่ยนแปลง
เขย่า สังเกตการเปลี่ยนแปลง
ตอนที่ 2 สารประกอบของแมงกานีส
1. ใส่ NaOH 0.5 g ลงในหลอดทดลองขนาดกลางและใส่ ลงไปจำนวน 0.33 g โดยให้อยู่บน NaOH แล้วเผาจน NaOH หลอมรวมเป็นเนื้อเดียวกับ
ลงไปจำนวน 0.33 g โดยให้อยู่บน NaOH แล้วเผาจน NaOH หลอมรวมเป็นเนื้อเดียวกับ ตั้งไว้ให้เย็นแล้วเติมน้ำกลั่นลงไป 5
ตั้งไว้ให้เย็นแล้วเติมน้ำกลั่นลงไป 5  เขย่า และตั้งไว้จนส่วนที่ไม่ละลายตกตะกอน สังเกตสีของสารละลาย
เขย่า และตั้งไว้จนส่วนที่ไม่ละลายตกตะกอน สังเกตสีของสารละลาย
2. รินสารละลายจากข้อ 1 ประมาณ 2 ใส่ในหลอดทดลองขนาดกลาง เติมสารละลาย
ใส่ในหลอดทดลองขนาดกลาง เติมสารละลาย 1 mol/
1 mol/ ลงไป 1
ลงไป 1  เขย่าและสังเกตการเปลี่ยนแปลง
เขย่าและสังเกตการเปลี่ยนแปลง
3. หยดสารละลาย 0.1 mol/
0.1 mol/ ลงในสารละลายข้อ 2 ทีละหยดและเขย่าจนตะกอนไม่เกิดเพิ่มขึ้น สังเกตสีของตะกอนและสารละลาย กรองแล้วเก็บสารละลายที่กรองได้ไว้ทำการทดลองต่อไป
ลงในสารละลายข้อ 2 ทีละหยดและเขย่าจนตะกอนไม่เกิดเพิ่มขึ้น สังเกตสีของตะกอนและสารละลาย กรองแล้วเก็บสารละลายที่กรองได้ไว้ทำการทดลองต่อไป
4. รินสารละลายจากข้อ 3 ประมาณ 2 เติมสารละลายNaOH 2mol/
เติมสารละลายNaOH 2mol/ ลงไปทีละหยดพร้อมกับเขย่า สังเกตสีของตะกอนที่เกิดขึ้นครั้งแรก แล้วเขย่าต่อไปอีกประมาณ 2 นาทีสังเกตสีของตะกอนและสารละลาย
ลงไปทีละหยดพร้อมกับเขย่า สังเกตสีของตะกอนที่เกิดขึ้นครั้งแรก แล้วเขย่าต่อไปอีกประมาณ 2 นาทีสังเกตสีของตะกอนและสารละลาย
1. ใส่ NaOH 0.5 g ลงในหลอดทดลองขนาดกลางและใส่
 ลงไปจำนวน 0.33 g โดยให้อยู่บน NaOH แล้วเผาจน NaOH หลอมรวมเป็นเนื้อเดียวกับ
ลงไปจำนวน 0.33 g โดยให้อยู่บน NaOH แล้วเผาจน NaOH หลอมรวมเป็นเนื้อเดียวกับ ตั้งไว้ให้เย็นแล้วเติมน้ำกลั่นลงไป 5
ตั้งไว้ให้เย็นแล้วเติมน้ำกลั่นลงไป 5  เขย่า และตั้งไว้จนส่วนที่ไม่ละลายตกตะกอน สังเกตสีของสารละลาย
เขย่า และตั้งไว้จนส่วนที่ไม่ละลายตกตะกอน สังเกตสีของสารละลาย2. รินสารละลายจากข้อ 1 ประมาณ 2
 ใส่ในหลอดทดลองขนาดกลาง เติมสารละลาย
ใส่ในหลอดทดลองขนาดกลาง เติมสารละลาย 1 mol/
1 mol/ ลงไป 1
ลงไป 1  เขย่าและสังเกตการเปลี่ยนแปลง
เขย่าและสังเกตการเปลี่ยนแปลง3. หยดสารละลาย
 0.1 mol/
0.1 mol/ ลงในสารละลายข้อ 2 ทีละหยดและเขย่าจนตะกอนไม่เกิดเพิ่มขึ้น สังเกตสีของตะกอนและสารละลาย กรองแล้วเก็บสารละลายที่กรองได้ไว้ทำการทดลองต่อไป
ลงในสารละลายข้อ 2 ทีละหยดและเขย่าจนตะกอนไม่เกิดเพิ่มขึ้น สังเกตสีของตะกอนและสารละลาย กรองแล้วเก็บสารละลายที่กรองได้ไว้ทำการทดลองต่อไป4. รินสารละลายจากข้อ 3 ประมาณ 2
 เติมสารละลายNaOH 2mol/
เติมสารละลายNaOH 2mol/ ลงไปทีละหยดพร้อมกับเขย่า สังเกตสีของตะกอนที่เกิดขึ้นครั้งแรก แล้วเขย่าต่อไปอีกประมาณ 2 นาทีสังเกตสีของตะกอนและสารละลาย
ลงไปทีละหยดพร้อมกับเขย่า สังเกตสีของตะกอนที่เกิดขึ้นครั้งแรก แล้วเขย่าต่อไปอีกประมาณ 2 นาทีสังเกตสีของตะกอนและสารละลาย |
| สีของสารประกอบและไอออนของโครเมียมและแมงกานีสในน้ำ * ไม่ละลายน้ำ |
 ไม่เกิดการเปลี่ยนแปลง เมื่อเติมสารละลายไฮโดรเจนเปอร์ออกไซด์ลงไปอีกสารหนึ่ง สารละลายเปลี่ยนเป็นสีเขียว แสดงว่าโครเมียมอะตอมใน
ไม่เกิดการเปลี่ยนแปลง เมื่อเติมสารละลายไฮโดรเจนเปอร์ออกไซด์ลงไปอีกสารหนึ่ง สารละลายเปลี่ยนเป็นสีเขียว แสดงว่าโครเมียมอะตอมใน ซึ่งมีเลขออกซิเดชัน +6 เปลี่ยนเป็น
ซึ่งมีเลขออกซิเดชัน +6 เปลี่ยนเป็น  ซึ่งมีเลขออกซิเดชัน +3 เขียนสมการแสดงปฏิกิริยาเคมีที่เกิดขึ้นในตอนที่ 1 ได้ดังนี้
ซึ่งมีเลขออกซิเดชัน +3 เขียนสมการแสดงปฏิกิริยาเคมีที่เกิดขึ้นในตอนที่ 1 ได้ดังนี้(9).jpg)
ในทำนองเดียวกันจากการทดลองตอนที่ 2 เขียนสมการแสดงปฏิกิริยาเคมีที่เกิดขึ้นได้ดังนี
(11).jpg)
2.6 ธาตุกัมมันตรังสี
กัมมันตภาพรังสี หมายถึงปรากฏการณ์ที่ธาตุแผ่รังสีได้เองอย่างต่อเนื่อง รังสีที่ได้จากการสลายตัว มี 3 ชนิด คือ รังสีแอลฟา รังสีบีตา และรังสีแกมมาในนิวเคลียสของธาตุประกอบด้วยโปรตอนซึ่ง มีประจุบวกและนิวตรอนซึ่งเป็นกลางทางไฟฟ้า สัดส่วนของจำนวนโปรตอนต่อจำนวนนิวตรอนไม่เหมาะสมจนทำให้ธาตุนั้นไม่เสถียร ธาตุนั้นจึงปล่อยรังสีออกมาเพื่อปรับตัวเองให้เสถียร ซึ่งเป็นกระบวนการที่เกิดขึ้นเองตามธรรมชาติ เช่น
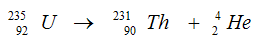 |
| (ธาตุยูเรเนียม) (ธาตุทอเลียม) (อนุภาคแอลฟา) |
จะเห็นได้ว่า การแผ่รังสีจะทำให้เกิดธาตุใหม่ได้ หรืออาจเป็นธาตุเดิมแต่จำนวนโปรตอนหรือนิวตรอนอาจไม่เท่ากับธาตุเดิม และธาตุกัมมันตรังสีแต่ละธาตุ มีระยะเวลาในการสลายตัวแตกต่างกันและแผ่รังสีได้แตกต่างกัน เรียกว่า ครึ่งชีวิตของธาตุ
กัมมันตภาพรังสี (radioactivity) เกิดจากการเสื่อมสลายโดยตัวเองของนิวเคลียสของอะตอมที่ไม่เสถียร เป็นผลให้ได้อนุภาคอัลฟา อนุภาคเบต้า และรังสีแกมมาซึ่งเป็นคลื่นแม่เหล็กไฟฟ้าที่มีช่วงคลื่นสั้นมากและมีพลังงาน สูง ทั้งหมดนี้พุ่งออกมาด้วยความเร็วสูงมาก ในบางกรณีอาจมีพลังงานความร้อนและพลังงานแสงเกิดตามมาด้วย เช่น การเสื่อมสลายของนิวเคลียสของธาตุเรเดียมไปเป็นธาตุเรดอน
รังสีแอลฟา
รังสีที่ประกอบด้วยอนุภาคแอลฟาซึ่งเป็นอนุภาคที่มีมวล 4 amu มีประจุ +2 อนุภาคชนิดนี้จะถูกกั้นไว้ด้วยแผ่นกระดาษหรือเพียงแค่ผิวหนังชั้นนอกของคนเราเท่านั้น
การสลายตัวให้รังสีแอลฟา
90Th 232----->88Ra 228 + 2a 4
รังสีเบต้า
รังสี ที่ประกอบด้วยอนุภาคอิเลคตรอนหรือโพสิตรอน รังสีนี้มีคุณสมบัติทะลุทะลวงตัวกลางได้ดีกว่ารังสีแอลฟา สามารถทะลุผ่านน้ำที่ลึกประมาณ 1 นิ้วหรือประมาณความหนาของผิวเนื้อที่ฝ่ามือได้ รังสีเบต้าจะถูกกั้นได้โดยใช้แผ่นอะลูมิเนียมชนิดบาง
การสลายตัวให้รังสีบีตา
79Au 198----->80Hg 198 + -1b 0
7N 13----->6C 13 + +1b 0
รังสีแกมมา
รังสี ที่เป็นคลื่นแม่เหล็กไฟฟ้าพลังงานสูง มีคุณสมบัติเช่นเดียวกันกับรังสีเอกซ์ที่สามารถทะลุผ่านร่างกายได้ การกำบังรังสีแกมมาต้องใช้วัสดุที่มีความหนาแน่นสูงเช่น ตะกั่วหรือยูเรเนียม เป็นต้น
การสลายตัวให้รังสีแกมมา
27Co 60----->-1b 0 + 28Ni 60----->28Ni60 + g
27Co 60----->-1b 0 + 28Ni 60----->28Ni60 + g

2.6.2 การสลายตัวของไอโซโทปกัมมันตรังสี
การที่ธาตุกัมมันตรังสีแผ่รังสีได้นั้นเป็นเพราะนิวเคลียสของธาตุไม่เสถียร เนื่องจากมีพลังงานส่วนเกินอยู่ภายใน ดังนั้นจึงจำเป็นต้องถ่ายเทพพลังงานส่วนเกินนี้ออกไป เพื่อให้นิวเคลียสเสถียรในที่สุด พลังงานส่วนเกินที่ปล่อยออกมาอยู่ในรูปของอนุภาคหรือรังสีต่าง ๆ เช่น อนุภาคแอลฟา อนุภาคบีตา รังสีแกมมาและไอโชโทปที่เสถียร จากการศึกษาไอโชโทปของธาตุจำนวนมาก พบว่าไอโชโทปที่นิวเคลียสมีอัตราส่วนระหว่าจำนวน นิวตรอนต่อโปรตอนไม่เหมาะสม คือนิวเคลียสที่มีจำนวนนิวตรอนมาก หรือ น้อยกว่าจำนวนโปรตอนมักจะไม่เสถียรจะมีการแผ่รังสีออกมาจนได้ไอโชโทปของธาตุใหม่ที่เสถียรกว่า นอกจากนั้นยังพบว่าจำนวนโปรตอนและนิวตรอนที่เป็นจำนวนคู่ หรือคี่ในนิวเคลียสนั้น มีความสัมพันธ์กับความเสถียรภาพของนิวเคลียสด้วย กล่าวคือ ไอโชโทปของธาตุที่มีจำนวนโปรตอน และนิวตรอนเป็นเลขคู่ จะเสถียรกว่าไอโชโทปของธาตุที่มีจำนวนโปรตอนและนิวตอนเป็นเลขคี่เช่น 714N เป็นไอโซโทปที่เสถียร 715Nพบว่า 714N มีจำนวนโปรตอนและจำนวนนิวตรอน จึงเสถียรกว่า 715Nที่มีจำนวนโปรตอนไม่เท่ากับจำนวนนิวตรอน816O เป็นไอโซโทปที่เสถียรกว่า817O เพราะ 816O มีจำนวนโปรตอนและจำนวนนิวตรอนเท่ากัน จึงเสถียรกว่า817O ที่มีจำนวนนิวตรอนเป็นเลขคี่ และจำนวนโปรตอนเป็นเลขคู่ธาตุกัมมันตรังสีในธรรมชาติ
ธาตุต่างๆที่พบในธรรมชาตินั้น ธาตุที่มีเลขอะตอมตั้งแต่ 83 ขึ้นไป ส่วนใหญ่สามารถแบ่งรังสีได้เช่น92238U 92235U 90232Th 86222Rn หรืออาจจะเขียนเป็น U-238, U-235, Th-232, Rn-222
นอกจากธาตุกัมมันตรังสีจะพบในธรรมชาติแล้ว นักวิทยาศาสตร์ยังสังเคราะห์ธาตุกัมมันตรังสีขึ้น
เพื่อใช้ประโยชน์ในด้านต่างๆอีกด้วย ซึ่งมีหลายวิธี แต่มีวิธีหนึ่งคือยิงนิวเคลียสของไอโซโทปที่เสถียรด้วยอนุภาคที่เหมาะสม และมีความเร็วสูง ได้ไอโซโทปของธาตุใหม่ที่เสถียร เช่น รัทเทอร์ฟอร์ด ได้ยิงนิวเคลียส N-14 ด้วยอนุภาคแอลฟา เกิด O-17
เขียนแผนภาพแทน คือ 14N( ) 17O ไอโซโทป817O ที่เสถียร พบในธรรมชาติ0.037%
การแผ่รังสีแอลฟา
เมื่อไอโซโทปกัมมันตรังสีให้อนุภาคแอลฟา นิวเคลียสของไอโซโทปเสีย 2 โปรตอน และ 2
นิวตรอน ดังนั้น ไอโซโทปกัมมันตรังสีจะเปลี่ยนไปเป็นธาตุอื่นที่มีเลขเชิงอะตอมต่ำกว่าเดิม 2 อะตอมและมีมวลต่ำกว่าเดิม 4 amu ตัวอย่างเช่น เมื่อ 92238U ให้อนุภาคแอลฟา ผลที่เกิดขึ้นจะให้ 90234Th สมการของปฏิกิริยาที่เกิดขึ้นเป็นดังนี้
92238U 24He+90234Th
การแผ่รังสีบีตา
การให้รังสีบีตาจะเกิดนิวเคลียสที่มีสัดส่วนของจำนวนนิวตรอนมากกว่าโปรตอน ตัวอย่างเช่น การแผ่รังสีบีตาของC-14 ไปเป็น N-14 C-14 ให้อนุภาคบีตา อนุภาคบีตาหรืออิเล็กตรอนเชื่อกันว่ามาจากนิวเคลียส เมื่อนิวตรอนสลายตัวไปเป็นโปรตอน 11H และอิเล็กตรอนดังนี้
01n----------> 11H+-10e
เมื่ออิเล็กตรอนเกิดขึ้น อิเล็กตรอนจะถูกปล่อยออกจากนิวเคลียสด้วยความเร็วสูงแต่โปรตอนยังคงอยู่ผลที่เกิดขึ้นทำให้นิวเคลียสมีจำนวนนิวตรอนลดลงไป 1 นิวตรอน และมีโปรตอนเพิ่มขึ้นอีก 1 โปรตอน ในกรณี C-14 ให้อนุภาคบีตา สมการ นิวเคลียร์จะเป็นดังนี้
614C------- >714 N+-10e
จากสมการจะเห็นว่าเลขเชิงอะตอมเพิ่มขึ้น 1 หน่วย และเลขมวลมีค่าคงที่
การแผ่รังสีแกมมา
การให้อนุภาคแอลฟาหรืออนุภาคอย่างใดอย่างหนึ่ง มักจะติดตามด้วยการแผ่รังสีแกมมา รังสีแกมมาถูกปล่อยออกมาเมื่อนิวเคลียสเปลี่ยนจากสถานะเร้าหรือสถานะพลังงานสูง ไปยังสถานะที่มีพลังงานต่ำกว่าเนื่องจากรังสีแกมมาไม่มีทั้งประจุและมวล การแผ่รังสีแกมมาจึงไม่ทำให้มีการเปลี่ยนแปลงเลขมวลหรือเลขเชิงอะตอมของนิวเคลียสอย่างใดอย่างหนึ่ง รังสีแกมมานำไปใช่รักษาโรค เป็นรังสีแกมมาที่มาจากเทคนิเทียม
4399Tc------> 4399Tc+y
เมื่อ Ra-226เปลี่ยนไปเป็น Rn-222 โดยการแผ่รังสีแอลฟานั้น Rn-222 ไม่เสถียรภาพจึงแผ่รังสีแกมมาออกมา
2.6.3 อันตรายจากไอโซโทปกัมมันตรังสี
อันตรายจากกัมมันตภาพรังสีในสมัยสงครามโลกครั้งที่ 2 มีการใช้ระเบิดปรมาณูทำลายศัตรู พลังงานอันมหาศาลของปฏิกิริยานิวเคลียร์ฟิชชันได้ทำลายสิ่งก่อสร้างและชีวิตมนุษย์เป็นจำนวนมาก เดิมทีคิดกันว่ามนุษย์ตายเพราะแรงระเบิดเท่านั้น เพราะยังไม่เคยมีการศึกษาผลกระทบของกัมมันตภาพรังสีต่อสิ่งมีชีวิต รวมทั้งไม่มีเครื่องมือตรวจสอบกัมมันตภาพรังสีที่บริเวณถูกระเบิดและในร่างกายผู้เคราะห์ร้าย แต่หลังจากการระเบิดของระเบิดปรมาณูประมาณ 1 ปี ก็พบว่ามีคนจำนวนมากเสียชีวิตด้วยโรคมะเร็งเพราะได้รับกัมมันตภาพรังสี ด้วยเหตุนี้โลกจึงเริ่มตื่นตัวศึกษาผลกระทบของกัมมันตภาพรังสีที่มีต่อชีวิตมนุษย์
เมื่อกัมมันตภาพรังสีจากธาตุกัมมันตภาพรังสีผ่านเข้าไปในเนื้อเยื่อของสิ่งมีชีวิตจะทำให้เนื้อเยื่อเปลี่ยนแปลงคือ อาจทำให้เนื้อเยื่อตายทันทีหรือเปลี่ยนแปลงไป ซึ่งอาจนำไปสู่สาเหตุของการเป็นโรคมะเร็งได้
ความรุนแรงของอันตรายที่เกิดต่อร่างกายซึ่งได้รับกัมมันตภาพรังสี ขึ้นกับปริมาณของกัมมันตภาพรังสีในช่วงเวลาที่ร่างกายได้รับ และส่วนของร่างกายที่รับกัมมันตภาพรังสีนั้น
ตามปกติมนุษย์ได้รับกัมมันตภาพรังสีจากสภาพแวดล้อมในธรรมชาติอยู่ตลอดเวลาแล้วแต่ในปริมาณที่น้อยจึงไม่เป็นอันตรายใดๆ การบำบัดโรคด้วยสารกัมมันตภาพรังสีหรือการตั้งถิ่นฐานอยู่ใกล้โรงไฟฟ้านิวเคลียร์ จะทำให้ร่างกายได้รับกัมมันตภาพรังสีในปริมาณสูง แต่ก็ยังไม่เป็นอันตรายเฉียบพลันเหมือนกับอยู่ในเหตุการณ์การระเบิดของปรมาณูหรือการระเบิดในโรงไฟฟ้านิวเคลียร์ อาการที่ปรากฏหลังจากที่ร่างกายได้รับกัมมันตภาพรังสี จะมีอาการคลื่นไส้ เบื่ออาหาร ปวดศีรษะ ถ้าอาการหนักผมอาจร่วง แต่ส่วนใหญ่แล้วอาการเหล่านี้จะไม่ปรากฏในทันที ดังนั้นประชาชนและผู้เกี่ยวข้องกับกัมมันตภาพรังสีจึงไม่ใส่ใจต่อการป้องกันอันตราย
เมื่อเนื้อเยื่อของร่างกายได้รับกัมมันตภาพรังสีจะทำให้อิเล็กตรอนหลุดจากอะตอม หรือพันธะเคมีเสียหายทำให้มีการเปลี่ยนแปลงทางกายภาพของเซลล์ ความเสียหายมีตั้งแต่เล็กน้อยร่างกายสามารถรักษาตัวเองได้ จนถึงเสียหายมากขึ้นอยู่กับปริมาณของกัมมันตภาพรังสีและระยะเวลาที่ได้รับ โดยเฉพาะเนื้อเยื่อสมองและเนื้อเยื่อบริเวณอวัยวะสืบพันธุ์เป็นตำแหน่งของร่างกายที่ไวต่อการรับกัมมันตภาพรังสีมากที่สุด สำหรับเนื้อเยื่อบริเวณอวัยวะสืบพันธุ์ที่ทำหน้าที่สร้างอสุจิและไข่ เมื่อได้รับกัมมันตภาพรังสี อาจทำให้โครโมโซมของเซลล์มีการเปลี่ยนแปลง ถ้าเป็นการเปลี่ยนแปลงชนิดถาวร เมื่อมีการผสมพันธุ์ผลของการเปลี่ยนแปลงนี้จะถูกถ่ายทอดสู่ลูกหลาน เป็นผลให้เกิดการกลายพันธุ์
การกลายพันธุ์สามารถทำให้เกิดผลดีและผลเสียก็ได้ แต่เป็นที่น่าเสียดายที่กลายพันธุ์ส่วนใหญ่ให้ผลเสีย ดังนั้นการกลายพันธุ์จากการได้รับกัมมันตภาพรังสีจึงนับเป็นอันตรายต่อชาติพันธุ์มนุษย์มาก เมื่อเป็นเช่นนี้หลายประเทศจึงได้มีการลงนามในสนธิสัญญาเพื่อป้องกันอันตรายจากกัมมันตภาพรังสี เช่น ไม่ทดลองระเบิดนิวเคลียร์
การปนเปื้อนกัมมันตภาพรังสีในสิ่งแวดล้อมบางครั้งก็อาจเกิดจากอุบัติเหตุได้ เช่น ในปีพ.ศ. 2529 โรงไฟฟ้านิวเคลียร์แห่งหนึ่งในทวีปยุโรปเกิดอุบัติเหตุ ทำให้มีฝุ่นกัมมันตภาพรังสีปริมาณมากลอยกระจายในอากาศเป็นบริเวณกว้างไกล เป็นเหตุให้อาหารประเภทเนื้อสัตว์ นม และพืชผักในบริเวณนั้น มีปริมาณกัมมันตภาพรังสีสูงกว่าปกติจนเกินระดับความปลอดภัยที่มนุษย์จะรับได้ หลายประเทศได้งดซื้ออาหารจากแหล่งที่มีกัมมันตภาพรังสีปริมาณสูง เพราะถ้าบริโภคเข้าไปจะเป็นอันตรายต่อร่างกาย เช่น ทำให้เจ็บป่วย อ่อนเพลีย คลื่นไส้ หรือเป็นมะเร็งได้
นอกจากที่กล่าวมา การปนเปื้อนกัมมันตภาพรังสีก็อาจเกิดจากโรงไฟฟ้านิวเคลียร์ เพราะสถานที่เหล่านี้มีของที่ปนเปื้อนด้วยสารกัมมันตภาพรังสี จากโรงงานที่ใช้เตาปฏิกรณ์ปรมาณู และโรงไฟฟ้านิวเคลียร์ เพราะสถานที่เหล่านี้มีของที่ปนเปื้อนด้วยสารกัมมันตภาพรังสีรวมอยู่ด้วยและถ้าไม่มีระบบกำจัดของเสียที่ถูกต้องและเหมาะสม ก็จะทำให้มีการแพร่กระจายกัมมันตภาพรังสี ซึ่งจะทำให้สภาพแวดล้อมเสียหายและเป็นอันตรายต่อชีวิตมนุษย์ได้
2.6.4 ครึ่งชีวิตของไอโซโทปกัมมันตรังสี
ครึ่งชีวิตของธาตุ (half life) หมายถึง ระยะเวลาที่สารสลายตัวไปจนเหลือเพียงครึ่งหนึ่งของปริมาณเดิมใช้สัญลักษณ์เป็น t1/2 นิวเคลียสของธาตุกัมมันตรังสีที่ไม่เสถียร จะสลายตัวและแผ่รังสีได้เองตลอดเวลาโดยไม่ขึ้นอยู่กับอุณหภูมิหรือความดัน อัตราการสลายตัว เป็นสัดส่วนโดยตรงกับจำนวนอนุภาคในธาตุกัมมันตรังสีนั้น ปริมาณการสลายตัวจะบอกเป็นครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทปตัวอย่างเช่น C-14 มีครึ่งชีวิต 5730 ปี หมายความว่า ถ้ามี C-14 1 กรัม เมื่อเวลาผ่านไป 5730 ปี จะเหลือ C-14 อยู่ 0.5 กรัม และเมื่อเวลาผ่านไปอีก 5730 ปี จะเหลืออยู่ 0.25 กรัม เป็นดังนี้ไปเรื่อยๆ กล่าวได้ว่าทุกๆ 5730 ปี จะเหลือ C-14เพียงครึ่งหนึ่งของปริมาณเดิม
ครึ่งชีวิตเป็นสมบัติเฉพาะตัวของแต่ละไอโซโทป และสามารถใช้เปรียบเทียบอัตราการสลายตัวของธาตุกัมมันตรังสีแต่ละชนิดได้ ตัวย่างครึ่งชีวิตของไอโซโทปกัมมันตรังสีบางชนิด ครึ่งชีวิตของธาตุกัมมันตรังสีชนิดต่างๆมีค่าไม่เท่ากัน เช่น เทคนีเทียม -99 มีครึ่งชีวิต 6 ชั่วโมงเท่านั้น ส่วนยูเรเนียม -235 มีครึ่งชีวิต 4.5 ล้านปี
ครึ่งชีวิต (half life) ของสารกัมมันตรังสี สามารถนำไปใช้หาอายุอายุสัมบูรณ์ (Absolute Age) เป็นอายุของหินหรือซากดึกดำบรรพ์ ที่สามารถบอกจำนวนปีที่ค่อนข้างแน่นอน การหาอายุสัมบูรณ์ใช้วิธีคำนวณจากครึ่งชีวิต ของธาตุกัมมันตรังสีที่มีอยู่ในหิน หรือซากดึกดำบรรพ์ที่ต้องการศึกษา ธาตุกัมมันตรังสีที่นิยมนำมาหาอายุสัมบูรณ์ได้แก่ ธาตุคาร์บอน – 14 ธาตุโพแทศเซียม – 40 ธตาเรเดียม – 226 และธาตุยูเรเนียม – 238 เป็นต้น การหาอายุสัมบูรณ์มักใช้กับหินที่มีอายุมากเป็นแสนล้านปี เช่น หินแกรนิตบริเวณฝั่งตะวันตกของเกาะภูเก็ต ซึ่งเคยเป็นหินต้นกำเนิดแร่ดีบุกมีอายุสัมบูรณ์ประมาณ 100 ล้านปี ส่วนตะกอนและซากดึกดำบรรพ์ที่มีอายุน้อยกว่า 50,000 ปี มักจะใช้วิธีกัมมันตภาพรังสีคาร์บอน – 14 เช่น ซากหอยนางรมที่วัดเจดีย์หอย อำเภอลาดหลุมแก้ว จังหวัดปทุมธานี มีอายุประมาณ 5,500 ปีของวัตถุโบราณ
นอกจากนั้นยังใช้คำนวณอายุของโลก พบว่าว่าประมาณครึ่งหนึ่งของยูเรเนียมที่มีมาแต่แรกเริ่มได้สลายตัวเป็นตะกั่วไปแล้ว ดังนั้นอายุของโลกคือประมาณครึ่งชีวิตของยูเรเนียม หรือราว 4,500 ล้านปี
 |
| ตารางครึ่งชีวิตของธาตุกัมมันตรังสีบางชนิด |
 |
| แสดงครึ่งชีวิตของธาตุกัมมันตรังสีบางธาตุและชนิดของการสลายตัว |
ครึ่งชีวิตสามารถใช้หาอายุของวัตถุโบราณที่มีธาตุคาร์บอนเป็นองค์ประกอบ เรียกว่าวิธี Radiocarbon Dating ซึ่งคำว่า dating หมายถึง การหาอายุจึงมักใช้หาอายุของวัตถุโบราณที่มีคุณค่าทางประวิติศาสตร์
หลักการสำคัญของการหาอายุวัตถุโบราณโดยวิธี Radiocarbon Dating เป็นหลักการที่อาศัยความรู้เกี่ยวกับกัมมันตภาพรังสีที่เกิดขึ้นเองในอากาศ ตัวการที่สำคัญคือ รังสีคอสมิก ซึงอยู่ในบรรยากาศเหนือพื้นโลก มีความเข้มสูงจนทำให้นิวเคลียสขององค์ประกอบของอากาศแตกตัวออก ให้อนุภาคนิวตรอน แล้วอนุภาคนิวตรอนชนกับไนโตรเจนในอากาศ
ข้อควรจำ
1. ในทางปฏิบัติการวัดหาจำนวนนิวเคลียสโดยตรงกระทำได้ยาก และเนื่องจากจำนวนนิวเคลียสในสารหนึ่ง ๆ จะเป็นสัดส่วนกับปริมาณของสารนั้น ๆ ดังนั้นจึงพิจารณาเป็นค่ากัมมันตภาพหรืการวัดมวลแทน ดังนี้ |
| โดยที่ A0 คือกัมมันตภาพที่เวลาเริ่มต้น (t=0) |
| โดยที่ m0 คือมวลสารตั้งต้นที่เวลาเริ่มต้น (t=0) |
ประโยชน์และโทษของธาตุกัมมันตรังสี
ในทางอุตสาหกรรม ใช้รังสีวัดวามหนาของวัสดุในโรงงานผลิตกระดาษ ผลิตแผ่นยาง และแผ่นโลหะ ใช้รังสีในการวิเคราะห์ส่วนประกอบของผลิตภัณฑ์ เช่น โลหะผสม แร่ ถ่านหิน และตรวจสอบรอยเชื่อม–รอนร้าวในโลหะหรือโครงสร้างอาคาร ใช้ยูเรเนียมเป็นเชื้อเพลิงสำหรับผลิตกระแสไฟฟ้าในโรงไฟฟ้านิวเคลียร์
ทางการเกษตร ใช้รังสีในการถนอมอาหารเพื่อยืดอายุการเก็บรักษาอาหาร เพราะรังสีจะทำลายแบคทีเรียและจุลินทรีย์ที่ก่อให้เกิดการเน่าเสียในอาหาร ใช้รังสีเพื่อปรับปรุงพันธุ์พืชให้มีความแข็งแรงต้านทานต่อโรคและแมลง เพื่อเพิ่มผลผลิตให้สูงขึ้น
ทางการเกษตร ใช้รังสีในการถนอมอาหารเพื่อยืดอายุการเก็บรักษาอาหาร เพราะรังสีจะทำลายแบคทีเรียและจุลินทรีย์ที่ก่อให้เกิดการเน่าเสียในอาหาร ใช้รังสีเพื่อปรับปรุงพันธุ์พืชให้มีความแข็งแรงต้านทานต่อโรคและแมลง เพื่อเพิ่มผลผลิตให้สูงขึ้น
2.6.5 ปฏิกิริยานิวเคลียร์
ปฏิกิริยานิวเคลียร์ คือ ปฏิกิริยาที่เกิดความเปลี่ยนแปลงกับนิวเคลียสของอะตอม ไม่ว่าจะเป็นการเพิ่ม หรือลดโปรตอน หรือนิวตรอนในนิวเคลียสของอะตอม เช่น ปฏิกิริยานี้จะเห็นได้ว่าโซเดียม ได้มีการรับนิวตรอนเข้าไป เมื่อนิวเคลียสเกิดความไม่เสถียร จึงเกิดการคายพลังงานออกมา และพลังงานที่คายออกมานั้น เมื่ออยู่ในรูปคลื่นแม่เหล็กไฟฟ้าแล้ว มันก็คือรังสีแกมมานั่นเอง
โดยทั่วไปรังสีแกมมาที่แผ่ออกมาจากนิวเคลียสของอะตอมที่ไม่เสถียรนั้น มักจะมีค่าพลังงานที่แตกต่างกันไปตามแต่ละชนิดของไอโซโทป ซึ่งถือเป็นคุณลักษณะประจำไอโซโทปนั้น ๆ
ปฏิกิริยานิวเคลียร์นั้นมีมากมายหลายรูปแบบ ซึ่งในบรรดารูปแบบทั้งหมดที่เราค้นพบในปัจจุบัน จะมีเพียง 2 รูปแบบที่เราพูดถึงกันบ่อย ๆ นั่นก็คือปฏิกิริยานิวเคลียร์ฟิชชัน (Fission) และปฏิกิริยานิวเคลียร์ฟิวชัน (Fusion)
 |
| ปฏิกิริยานิวเคลียร์ฟิชชัน |
โมเดลแสดงการเกิดปฏิกิริยานิวเคลียร์ฟิชชัน
ปฏิกิริยานิวเคลียร์ฟิชชัน (Fission Process) เป็นการแตกนิวเคลียสของอะตอมจากอะตอมของธาตุใหญ่ให้กลายเป็นอะตอมของธาตุเล็ก 2 อะตอม ซึ่งในกระบวนการนี้จะให้พลังงานออกมาด้วย เช่น
ซึ่งในปฏิกิริยาที่ยกตัวอย่างนี้ ไอโซโทปของแบเรียม (Ba) และคริปตอน (Kr) ซึ่งไอโซโทปทั้งสองตัวนี้มีนิวตรอนมากกว่าปกติ จึงมีการคายพลังงานออกมาในรูปของรังสีเบตา
อย่างไรก็ตาม ถึงแม้ว่าในตัวอย่างนี้สารผลิตภัณฑ์ที่ได้จากปฏิกิริยาจะเป็นกากกัมมันตรังสีที่แผ่รังสีเบตา (Beta Ray) แต่ก็ยังมีปฏิกิริยาอื่น ๆ ที่แผ่รังสีชนิดอื่น ๆ รวมไปถึงรังสีแกมมา ตัวอย่างนี้เป็นเพียงการทำให้เห็นภาพว่าผลิตภัณฑ์ที่ได้จากปฏิกิริยา นิวเคลียร์ฟิชชันจะคายพลังงานออกมา นั่นก็เป็นเพราะโดยทั่วไปเมื่อธาตุที่มีมวลหรือเป็นธาตุหนักขึ้น จำนวนของนิวตรอนก็เริ่มที่จะมากกว่าโปรตอนไปด้วยตามลำดับ ซึ่งเมื่ออะตอมเหล่านี้แตกตัวมาเป็นอะตอมของธาตุที่เล็กกว่า ก็ย่อมทำให้จำนวนนิวตรอนของอะตอมมากกว่าปกติ
 |
| ปฏิกิริยานิวเคลียร์ฟิวชัน |
โมเดลแสดงการเกิดปฏิกิริยานิวเคลียร์ฟิวชัน
สำหรับปฏิกิริยานิวเคลียร์ฟิวชัน (Fusion Process) จะตรงข้ามกับฟิชชัน นั่นคือแทนที่จะแตกอะตอมของธาตุหนักให้เป็นธาตุเบา ก็จะกลายเป็นการรวมธาตุเบาสองอะตอมให้กลายเป็นอะตอมเดียวที่หนักขึ้น เช่นตัวอย่างนี้
จะเห็นได้ว่า ผลิตภัณฑ์ของปฏิกิริยานี้ เราจะได้ฮีเลียม (He) ที่มีจำนวนนิวตรอนน้อยกว่าปกติ (ปกติฮีเลียมจะมีนิวตรอน 2 ตัว) ซึ่งสภาพที่ไม่เสถียรของอะตอมนี้เอง จึงทำให้เกิดการคายพลังงานออกมาได้
2.6.6เทคโนโลยีที่เกี่ยวข้องกับการใช้สารกัมมันตรังสี
เครื่องมือตรวจการแผ่รังสีวิธีตรวจการแผ่รังสีทำได้ง่ายๆ โดยนำฟิล์มถ่ายรูปมาหุ้มสารที่คิดว่ามีสารกัมมันตรังสีปนอยู่ เก็บในที่มืด เมื่อนำฟิล์มไปล้าง ถ้าปรากฏว่าเป็นสีดำแสดงว่ามีการแผ่รังสี หรืออาจจะทำได้โดยนำสารที่จะทดสอบไปวางใกล้สารเรืองแสง ถ้ามีการเรืองแสงเกิดขึ้นแสดงว่ามีการแผ่รังสีเกิดขึ้น อย่างไรก็ตามการตรวจอย่างง่าย ๆ ดังกล่าวไม่สามารถบอกปริมาณของรังสีได้ จึงต้องใช้เครื่องมือตรวจสอบโดยเฉพาะเรียกว่า “ไกเกอร์มูลเลอร์เคาน์เตอร์” (Geiger-Muller counter) ซึ่งประกอบด้วยกระบอกรับรังสี และมิเตอร์ที่มีหน้าปัดบอกปริมาณรังสีได้ลักษณะของไกเกอร์ประกอบด้วยกระบอกซึ่งบรรจุก๊าซอาร์กอนไว้ เมื่อนำไปวางไว้ในบริเวณที่มีการแผ่รังสี รังสีจะผ่านเข้าทางช่องด้านหน้าของกระบอก กระทบกับอะตอมของอาร์กอน ทำให้อิเล็กตรอนของอาร์กอนหลุดออกไป กลายเป็นAr + ก่อให้เกิดความต่างศักย์ระหว่าง Ar + กับ e - ในหลอด ซึ่งจะแปลงค่าความ ต่างศักย์ออกมาเป็นตัวเลขบนหน้าปัด ค่าที่ได้นี้จะมากหรือน้อยก็ขึ้นอยู่กับชนิดของรังสี และความเข้มข้นของรังสีที่จะทำให้Ar กลายเป็น Ar + ได้มากหรือน้อยสารกัมมันตรังสีแต่ละสารมีครึ่งชีวิตไม่เท่ากัน และแผ่รังสี
แตกต่างกัน การนำสารกัมมันตรังสีมาใช้ประโยชน์จึงแตกต่างกัน ดังตัวอย่าง
ด้านธรณีวิทยา
ด้านธรณีวิทยา
ใช้คาร์บอน - 14 ซึ่งมีครึ่งชีวิต 5,730 ปี หาอายุของวัตถุโบราณที่มีคาร์บอนเป็นองค์ประกอบเช่น ไม้ กระดูก หรือสารอินทรีย์อื่น ๆ การหาอายุวัตถุโบราณโดยการวัดปริมาณของ คาร์บอน – 14 ซึ่งเกิดจากไนโตรเจนรวมตัวกับนิวตรอนจากรังสีคอสมิก ดังปฏิกิริยา
ในบรรยากาศ คาร์บอนทำปฏิกิริยากับออกซิเจน ได้เป็น CO2 ซึ่งทำให้มีทั้ง 12CO2 และ 14CO2 ปนกัน เมื่อพืชนำไปใช้ในการสังเคราะห์แสง C-14 จะอยู่ในพืชและเมื่อสัตว์กินพืชเป็นอาหาร C-14 ก็จะเข้าไปอยู่ในร่างกาย ในขณะที่พืชและสัตว์มีชีวิต 14CO2 จะเข้าไปและขับออกมาอยู่ตลอดเวลา ทำให้มี C-14 ด้วยสัดส่วนคงที่แน่นอน แต่เมื่อสิ่งมีชีวิตตายลงการรับ C-14 ก็จะหยุดลง ปริมาณ C-14 ก็จะลดลงเพราะเกิดการสลายตัวตัวตลอดเวลา ดังนั้นถ้าทราบอัตราการสลายตัวของ C-14 ในขณะที่ยังมีชีวิตอยู่และทราบอัตราการสลายตัว
ขณะนั้น ก็สามารถคำนวณอายุได้
ด้านการแพทย์
ในบรรยากาศ คาร์บอนทำปฏิกิริยากับออกซิเจน ได้เป็น CO2 ซึ่งทำให้มีทั้ง 12CO2 และ 14CO2 ปนกัน เมื่อพืชนำไปใช้ในการสังเคราะห์แสง C-14 จะอยู่ในพืชและเมื่อสัตว์กินพืชเป็นอาหาร C-14 ก็จะเข้าไปอยู่ในร่างกาย ในขณะที่พืชและสัตว์มีชีวิต 14CO2 จะเข้าไปและขับออกมาอยู่ตลอดเวลา ทำให้มี C-14 ด้วยสัดส่วนคงที่แน่นอน แต่เมื่อสิ่งมีชีวิตตายลงการรับ C-14 ก็จะหยุดลง ปริมาณ C-14 ก็จะลดลงเพราะเกิดการสลายตัวตัวตลอดเวลา ดังนั้นถ้าทราบอัตราการสลายตัวของ C-14 ในขณะที่ยังมีชีวิตอยู่และทราบอัตราการสลายตัว
ขณะนั้น ก็สามารถคำนวณอายุได้
ด้านการแพทย์
ใช้เพื่อศึกษาความผิดปกติของอวัยวะต่าง ๆ ในร่างกาย โดยให้คนไข้รับประทานอาหารหรือยาที่มีไอโซโทปกัมมันตรังสีจำนวนเล็กน้อย จากนั้นใช้เครื่องมือตรวจสอบรังสีเพื่อติดตามดูผลการดูดซึมไอโซโทปกัมมันตรังสีของระบบอวัยวะต่าง ๆ เช่น ให้ดื่มสารละลายไอโอดีน – 131 แล้วติดตามดูความผิดปกติของต่อมไทรอยด์ ใช้ไอโอดีน – 132 ติดตามดูภาพสมอง ฉีดโซเดียม – 24 เข้าเส้นเลือดโดยตรงเพื่อดู ระบบการไหลเวียนของเลือด รับประทาน เทคนีเซียม– 99 เมื่อต้องการดูภาพหัวใจ ตับ ปอด นอกจากนี้แพทย์ ยังใช้ไอโซโทปกัมมันตรังสีรักษาโรคโดยตรง เช่น ใช้โคบอลต์ – 60 หรือเรเดียม – 226 ในการรักษา โรคมะเร็ง
ด้านเกษตรกรรม
ด้านเกษตรกรรม
ใช้ไอโซโทปกัมมันตรังสีในการติดตามระยะเวลาของการหมุนเวียนแร่ธาตุในพืช โดยเริ่มต้น จากการดูดซึมที่รากจนถึงการคายออกที่ใบหรือจำนวนแร่ธาตุที่พืชสะสมไว้ที่ใบ เช่น ใช้ฟอสฟอรัส –32 จำนวนเล็กน้อยผสมกับฟอสฟอรัสที่ไม่มีรังสีเพื่อทำปุ๋ย แล้วใช้รังสีเพื่อการปรับปรุงเมล็ดพืช ให้ได้ พันธุกรรมตามต้องการ โดยการนำเมล็ดพันธุ์พืชมาอาบรังสีนิวตรอนในปริมาณและระยะเวลาที่เหมาะสม จะทำให้เกิดการกลายพันธุ์ได้
ด้านอุตสาหกรรม
ด้านอุตสาหกรรม
ใช้ไอโซโทปกัมมันตรังสีกับงานหลายอย่าง เช่น ใช้ตรวจหารอยตำหนิในโลหะหรือรอยรั่วของท่อขนส่งของเหลว โดยผสมกับไอโซโทปกัมมันตรังสีกับของเหลวที่จะขนส่งไปตามท่อ แล้วติดตามการแผ่รังสีด้วยเครื่องไกเกอร์ มูลเลอร์ เคาน์เตอร์ ถ้าบริเวณใดที่เครื่องมีสัญญาณจำนวนนับมากที่สุดแสดงว่าบริเวณนั้นมีการรั่วไหลเกิดขึ้น ใช้วัดความหนาของวัตถุเนื่องจากรังสีแต่ละชนิดทะลุวัตถุได้ดีไม่เท่ากัน ดังนั้นเมื่อผ่านรังสีไปยังแผ่นวัตถุต่าง ๆ เช่น โลหะ กระดาษ พลาสติก แล้ววัดความสามารถในการดูดซับรังสีของ
วัตถุนั้นด้วยเครื่องไกเกอร์ มูลเลอร์ เคาน์เตอร์เปรียบเทียบจำนวนนับกับตารางข้อมูลก็จะทำให้ทราบความหนาของวัตถุได้ ในอุตสาหกรรมการทำอัญมณีใช้รังสีเพื่อทำให้อัญมณีมีสีสันสวยงามขึ้น โดยใช้รังสีแกมมา นิวตรอน หรืออิเล็กตรอนพลังงานสูงฉายไปบนอัญมณี จะทำให้สารที่ทำให้เกิดสีบนอัญมณีเปลี่ยนสีไปได้
- อัญมณีที่ฉายด้วยรังสีแกมมาจะไม่มีรังสีตกค้างแต่การอาบด้วยนิวตรอนจะมีไอโซโทปกัมมันตรังสีเกิดขึ้น จึง
- ต้องปล่อยให้ไอโซโทปกัมมันตรังสีสลายตัวจนมีระดับที่ปลอดภัยจึงนำมาใช้ประโยชน์
การเก็บถนอมอาหาร ใช้โคบอลต์ – 60 ซึ่งจะให้รังสีแกมมาที่ไม่มีผลตกค้างและรังสีจะทำลายแบคทีเรียจึงช่วยเก็บรักษาอาหารไว้ได้นานหลายวันหลังจากการผ่านรังสีเข้าไปในอาหารแล้ว
1. ทำเตาปฏิกรณ์ปรมาณู ทำโรงงานไฟฟ้าพลังงานปรมาณู และเรือดำน้ำปรมาณู
2. ใช้สร้างธาตุใหม่หลังยูเรเนียม สร้างขึ้นโดยยิ่งนิวเคลียสของธาตุหนักด้วยอนุภาคแอลฟา หรือด้วยนิวเคลียสอื่นๆ ที่ค่อนข้างหนัก และมีพลังงานสูง
3. ใช้ศึกษากลไกของปฏิกิริยาเคมี เช่น การเกิดปฏิกิริยาของเอสเทอร์
4. ใช้ในการหาปริมาณวิเคราะห์
5. ใช้ในการหาอายุของซากสิ่งมีชีวิต (C - 14)
6. การรักษาโรค เช่น มะเร็ง (Ra - 226)
7. ใช้ในการถนอมอาหารให้อยู่ได้นานๆ ( Co-60)
8. ใช้ ศึกษาความต้องการปุ๋ยของพืช และปรับปรุงเมล็ดพันธุ์ที่ต้องการ (P - 32)
2.7.2 โทษของธาตุ
ถ้าร่างกายได้รับจะทำให้โมเลกุลภายในเซลล์เกิดการเปลี่ยนแปลงไม่สามารถทำงานตามปกติได้ ถ้าเป็นเซลล์ที่เกี่ยวข้องกับการถ่ายทอดลักษณะพันธุกรรมก็จะเกิดการผ่าเหล่า โดยเฉพาะเซลล์สืบพันธุ์ เมื่อเข้าไปในร่างกายจะไปสะสมในกระดูก ส่วนผลที่ทำให้เกิดความป่วยไข้จากรังสี เมื่ออวัยวะส่วนใดส่วนหนึ่งของร่างกายได้รับรังสี โมเลกุลของธาตุต่างๆ ที่ประกอบเป็นเซลล์จะแตกตัว ทำให้เกิดอาการป่วยไข้และเกิดมะเร็งได้
วัตถุนั้นด้วยเครื่องไกเกอร์ มูลเลอร์ เคาน์เตอร์เปรียบเทียบจำนวนนับกับตารางข้อมูลก็จะทำให้ทราบความหนาของวัตถุได้ ในอุตสาหกรรมการทำอัญมณีใช้รังสีเพื่อทำให้อัญมณีมีสีสันสวยงามขึ้น โดยใช้รังสีแกมมา นิวตรอน หรืออิเล็กตรอนพลังงานสูงฉายไปบนอัญมณี จะทำให้สารที่ทำให้เกิดสีบนอัญมณีเปลี่ยนสีไปได้
- อัญมณีที่ฉายด้วยรังสีแกมมาจะไม่มีรังสีตกค้างแต่การอาบด้วยนิวตรอนจะมีไอโซโทปกัมมันตรังสีเกิดขึ้น จึง
- ต้องปล่อยให้ไอโซโทปกัมมันตรังสีสลายตัวจนมีระดับที่ปลอดภัยจึงนำมาใช้ประโยชน์
การเก็บถนอมอาหาร ใช้โคบอลต์ – 60 ซึ่งจะให้รังสีแกมมาที่ไม่มีผลตกค้างและรังสีจะทำลายแบคทีเรียจึงช่วยเก็บรักษาอาหารไว้ได้นานหลายวันหลังจากการผ่านรังสีเข้าไปในอาหารแล้ว
2.7 การนำธาตุไปใช้ประโยชน์และผลกระทบต่อสิ่งมีชีวิต
2.7.1 ประโยชน์ของธาตุ1. ทำเตาปฏิกรณ์ปรมาณู ทำโรงงานไฟฟ้าพลังงานปรมาณู และเรือดำน้ำปรมาณู
2. ใช้สร้างธาตุใหม่หลังยูเรเนียม สร้างขึ้นโดยยิ่งนิวเคลียสของธาตุหนักด้วยอนุภาคแอลฟา หรือด้วยนิวเคลียสอื่นๆ ที่ค่อนข้างหนัก และมีพลังงานสูง
3. ใช้ศึกษากลไกของปฏิกิริยาเคมี เช่น การเกิดปฏิกิริยาของเอสเทอร์
4. ใช้ในการหาปริมาณวิเคราะห์
5. ใช้ในการหาอายุของซากสิ่งมีชีวิต (C - 14)
6. การรักษาโรค เช่น มะเร็ง (Ra - 226)
7. ใช้ในการถนอมอาหารให้อยู่ได้นานๆ ( Co-60)
8. ใช้ ศึกษาความต้องการปุ๋ยของพืช และปรับปรุงเมล็ดพันธุ์ที่ต้องการ (P - 32)
2.7.2 โทษของธาตุ
ถ้าร่างกายได้รับจะทำให้โมเลกุลภายในเซลล์เกิดการเปลี่ยนแปลงไม่สามารถทำงานตามปกติได้ ถ้าเป็นเซลล์ที่เกี่ยวข้องกับการถ่ายทอดลักษณะพันธุกรรมก็จะเกิดการผ่าเหล่า โดยเฉพาะเซลล์สืบพันธุ์ เมื่อเข้าไปในร่างกายจะไปสะสมในกระดูก ส่วนผลที่ทำให้เกิดความป่วยไข้จากรังสี เมื่ออวัยวะส่วนใดส่วนหนึ่งของร่างกายได้รับรังสี โมเลกุลของธาตุต่างๆ ที่ประกอบเป็นเซลล์จะแตกตัว ทำให้เกิดอาการป่วยไข้และเกิดมะเร็งได้



ไม่มีความคิดเห็น:
แสดงความคิดเห็น