3.1สัญลักษณ์แบบจุดของลิวอิสกฏออกเตต
ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 2 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่า พันธะคู่ เช่น ในโมเลกุลของออกซิเจนถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 3 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่า พันธะสาม เช่น ในโมเลกุลของไฮโดรเจนจากการศึกษาสารโคเวเลนซ์จะพบว่า ธาตุที่จะสร้างพันธะโคเวเลนต์ส่วนมากเป็นธาตุอโลหะกับอโลหะ ทั้งนี้เนื่องจากโลหะมีพลังงานไอออไนเซชันค่อนข้างสูง จึงเสียอิเล็กตรอนได้ยาก เมื่ออโลหะรวมกันเป็นโมเลกุลจึงไม่มีอะตอมใดเสียอิเล็กตรอน มีแต่ใช้อิเล็กตรอนร่วมกันเกิดเป็นพันธะโคเวเลนต์ อย่างไรก็ตามโลหะบางชนิดก็สามารถเกิดพันธะโคเวเลนต์กับอโลหะได้ เช่น Be เกิดเป็นสารโคเวเลนซ์คือ BeCl2เป็นต้นชนิดของพันธะโคเวเลนต์
อะตอมที่เกิดพันธะ นักเคมีนิยมใช้การเขียนสัญลักษณ์แบบจุดของลิวอิส โดยประกอบด้วยสัญลักษณ์แทนนิวเคลียสกับอิเล็กตรอนในชั้นถัดจากเวเลนซ์อิเล็กตรอนเข้าไป และจุดรอบสัญลักษณ์แทนจำนวนเวเลนซ์อิเล็กตรอนของธาตุนั้น ๆ
ชนิดของพันธะโคเวเลนต์
พิจารณาจากจำนวนอิเล็กตรอนที่ใช้ร่วมกันของอะตอมคู่ร่วมพันธะ ดังนี้
ก. พันธะเดี่ยว เป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมคู่สร้างพันธะทั้งสองใช้อิเล็กตรอนร่วมกัน1 คู่ ใช้เส้น ( - ) แทนพันธะเดี่ยว
ข. พันธะคู่เป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมคู่สร้างพันธะทั้งสองใช้อิเล็กตรอนร่วมกัน 2 คู่ ใช้เส้น 2 เส้น (= ) แทน 1 พันธะคู่ เช่น พันธะระหว่าง O ใน O2, O กับ C ใน CO2, C กับ H ใน C2H4
ค. พันธะสามเป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมคู่สร้างพันธะทั้งสองใช้อิเล็กตรอนร่วมกัน 3 คู่ ใช้เส้น 3 เส้น ( = ) แทน 1 พันธะสาม เช่น พันธะระหว่าง N กับ N ใน N2 , N กับ C ใน HCN
ชนิดของพันธะโคเวเลนต์
อะตอมที่เกิดพันธะ นักเคมีนิยมใช้การเขียนสัญลักษณ์แบบจุดของลิวอิส โดยประกอบด้วยสัญลักษณ์แทนนิวเคลียสกับอิเล็กตรอนในชั้นถัดจากเวเลนซ์อิเล็กตรอนเข้าไป และจุดรอบสัญลักษณ์แทนจำนวนเวเลนซ์อิเล็กตรอนของธาตุนั้น ๆ
ชนิดของพันธะโคเวเลนต์ พิจารณาจากจำนวนอิเล็กตรอนที่ใช้ร่วมกันของอะตอมคู่ร่วมพันธะ ดังนี้
ก. พันธะเดี่ยว เป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมคู่สร้างพันธะทั้งสองใช้อิเล็กตรอนร่วมกัน
1 คู่ ใช้เส้น ( - ) แทนพันธะเดี่ยว เช่น


ค. พันธะสามเป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมคู่สร้างพันธะทั้งสองใช้อิเล็กตรอนร่วมกัน 3 คู่ ใช้เส้น 3 เส้น ( = ) แทน 1 พันธะสาม เช่น พันธะระหว่าง N กับ N ใน N2, N กับ C ใน HCNตาราง โครงสร้างลิวอิสของโมเลกุลโคเวเลนต์บางชนิด

โมเลกุลที่ไม่เป็นไปตามกฏออกเตด1. อิเล็กตรอนรอบอะตอมกลางน้อยกว่า 8 ในสารประกอบบางชนิด จำนวนอิเล็กตรอนที่ล้อมรอบอะตอมกลางมีจำนวนน้อยกว่าแปด เช่น เบอร์ริลเลียม ซึ่งเป็นธาตุหมู่ 2A ซึ่งมีการจัดเรียงอิเล็กตรอนเป็น 1s22s2 มีเวเลนซ์อิเล็กตรอน 2 ตัว อยู่ที่ออร์บิตัล 2s ในสภานะแก๊ส เบอร์ริลเลียมไฮไดรด์ (BeH2)เป็นโมเลกุลที่เสถียรโดยมีโครงสร้างลิวอิสดังรูป
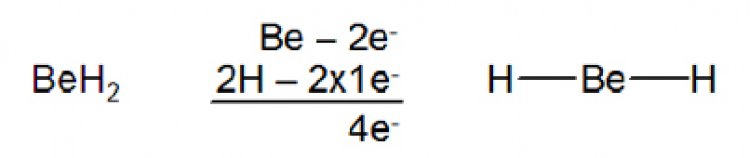

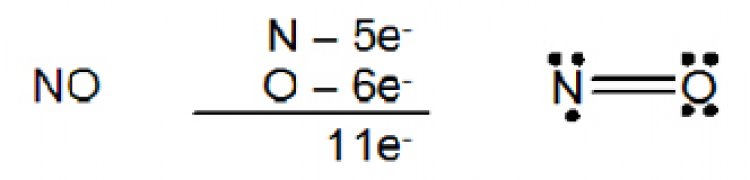

3.2 พันธะไอออนิก
พันธะไอออนิก คือ พันธะที่เกิดขึ้นอันเนื่องมาจากแรงดึงดูดทางไฟฟ้าสถิตระหว่างไอออนบวก(cation) และไอออนลบ(anion) อันเนื่องมาจากการถ่ายโอนอิเล็กตรอน จากโลหะให้แก่อโลหะ โดยทั่วไปแล้วพันธะไอออนิกเป็นพันธะที่เกิดขึ้นระหว่างโลหะและอโลหะ ทั้งนี้เนื่องจากว่าโลหะมีค่าพลังงานไอออไนเซชัน(ionization energy)ต่ำ แต่อโลหะมีค่าสัมพรรคภาพอิเล็กตรอน(electron affinity)สูง ดังนั้นโลหะจึงมีแนวโน้มที่จะให้อิเล็กตรอน และอโลหะมีแนวโน้มที่จะรับอิเล็กตรอน3.2.1 การเกิดพันธะไอออนิก
เมื่อโลหะเสียอิเล็กตรอนก็จะกลายเป็นไอออนบวกอโลหะเมื่อรับอิเล็กตรอนก็จะกลายเป็นไอออนลบ
การเกิดพันธะไอออนิก เกิดระหว่างโลหะกับอโลหะ ยกเว้น Be กับ B โดยโลหะจ่ายอิเล็กตรอนออกไปกลายเป็นประจุบวก อโลหะรับอิเล็กตรอนเข้ามากลายเป็นประจุลบ ประจุบวกและประจุลบที่เกิดขึ้นจะส่งแรงดึงดูดกัน เรียกว่า พันธะไอออนิก
1.โครงสร้างของสารประกอบไอออนิก
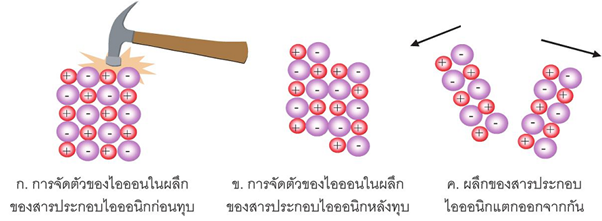
1. ผลึกโซเดียมคลอไรด์ พบว่า ในผลึกโซเดียมคลอไรด์ มีโซเดียมไอออนสลับกันกับคลอไรด์ไอออนเป็นแถว ๆ ทั้งสามมิติ มีลักษณะคล้ายตาข่าย โดยที่แต่ละไอออน จะมีไอออนต่างชนิดล้อมรอบอยู่ 6 ไออออน ดังรูป
ดังนั้นอัตราส่วนระหว่างไอออนบวก : ไอออนลบเท่ากับ 6 : 6 หรือ 1 : 1 สูตรอย่างง่ายจึงเป็น NaCl
2. ผลึกซีเซียมคลอไรด์ แต่ละไอออนจะมีไอออนต่างชนิดล้อมรอบอยู่ 8 ไอออน ดังรูป
ดังนั้นอัตราส่วนระหว่างไอออนบวก : ไอออนลบเท่ากับ 8 : 8 หรือ 1 : 1 สูตรอย่างง่ายจึงเป็น CsCl
จากตัวอย่างของโครงสร้างผลึกของโซเดียมคลอไรด์และซีเซียมคลอไรด์ จะมีลักษณะต่างกัน ถึงแม้ว่าเป็นธาตุในหมู่เดียวกัน เพราะมีขนาดไอออนต่างกัน
3.2.2สูตรเคมีและชื่อของสารประกอบไอออนิก
เนื่องจากสารประกอบไอออนิกมีลักษณะการสร้างพันธะต่อเนื่องกันเป็นผลึก ไม่ได้อยู่ในลักษณะของโมเลกุลเหมือนในสารประกอบโคเวเลนต์ ดังนั้นสารประกอบไอออนิกจึงไม่มีสูตรโมเลกุลที่แท้จริง แต่จะมีการเขียนสูตรเพื่อแสดงอัตราส่วนอย่างต่ำของจำนวนธาตุต่าง ๆ ที่เป็นองค์ประกอบ เช่น โซเดียมคลอไรด์ เกิดจากอะตอมของธาตุโซเดียม (Na) อย่างน้อยที่สุด 1 อะตอม และอะตอมของธาตุคลอรีน (Cl) อย่างน้อยที่สุด 1 อะตอม จึงสามารถเขียนสูตรได้เป็น NaCl โดยการเขียนสูตรของสารประกอบไอออนิกจะเขียนนำด้วยธาตุที่เกิดเป็นไอออนบวกก่อน จากนั้นจึงเขียนตามด้วยธาตุที่เกิดเป็นไอออนลบตามลำดับ
วิธีการอ่านชื่อสารประกอบไอออนิกให้อ่านตามลำดับของธาตุที่เขียนในสูตร คือ เริ่มจากธาตุแรกซึ่งเกิดเป็นไอออนบวก (ธาตุโลหะ) แล้วตามด้วยธาตุหลังซึ่งเป็นไอออนลบ (ธาตุอโลหะ) ดังนี้
1. เริ่มจากอ่านชื่อไอออนบวก (ธาตุโลหะ) ก่อน
2. อ่านชื่อธาตุไอออนลบ (ธาตุอโลหะ) โดยเปลี่ยนเสียงสุดท้ายเป็น -ไอด์ (-ide) ดังตัวอย่างเช่น
NaCl อ่านว่า โซเดียมคลอไรด์
MgO อ่านว่า แมกนีเซียมออกไซด์
Al2O3 อ่านว่า อะลูมิเนียมออกไซด์
3. หากไอออนลบมีลักษณะเป็นกลุ่มธาตุ จะมีชื่อเรียกเฉพาะที่แตกต่างกัน เช่น No3- เรียกว่า ไนเดรต, CO32- เรียกว่า คาร์บอเนต, SO42- เรียกว่า ซัลเฟต OH- เรียกว่า ไฮดรอกไซด์ เป็นต้น ดังตัวอย่างเช่น
CaCO3 อ่านว่า แคลเซียมคาร์บอเนต
Na2SO4 อ่านว่า โซเดียมซัลเฟต

3.2.3 พลังงานกับการเกิดสารประกอบไอออนิก
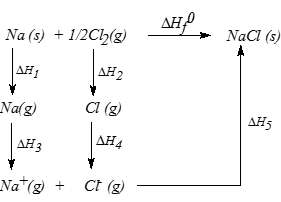
ในการเกิดพันธะไอออนิกหรือสารประกอบไอออนิก จะมีการเปลี่ยนแปลงหลายขั้นตอนด้วยกัน แต่จะมีกี่ขั้นขึ้นอยู่กับสมบัติของสารตั้งต้นและแต่ละขั้นตอนย่อยๆจะมีพลังงานเกี่ยวข้องอยู่ด้วย ดังตัวอย่างการเกิดสารประกอบโซเดียมคลอไรด์ (NaCl) มีขั้นตอนดังนี้
1.โลหะโซเดียมที่อยู่ในสถานะของแข็งระเหิดกลายเป็นไอ (กลายเป็นอะตอมในสถานะก๊าซ) ขั้นนี้ต้องใช้พลังงาน หรือดูดพลังงานเท่ากับ 109 kJ/mol เรียกพลังงานที่ใช้ในขั้นนี้ว่าพลังงานการระเหิด (Heat of siblimation) สัญลักษณ์ "Hs" หรือ "S"
Na(s)+ 109 kJ---------------->Na(g).........(1)
2.โมเลกุลของคลอรีน (Cl2(g)) ซึ่งอยู่ในสถานะก๊าซแตกตัวออกเป็นอะตอมในสถานะก๊าซ (Cl(g))
Cl(g) + 242 kJ -------------------> 2Cl(g)
แต่่ในการเกิด NaCl(s) 1 mol ต้องใช้ Cl(g) เพียง 1 mol ดังนั้น
Cl2(g) +121 kJ-------------------->Cl(g).........(2)
ขั้นนี้ต้องใช้พลังงานหรือดูดพลังงานเท่ากับ 121 kJ เรียกพลังงานที่ใช้ในขั้นนี้ว่า พลังงานสลายพันธะ หรือพลังงานการแตกตัว (Bond Dissociation energy) สัญลักษณ์ "Hdis" หรือ "d"
3.อะตอมของโซเดียมในสถานะก๊าซ เสีย 1 เวเลนซ์อิเลคตรอน กลายเป็นโซเดียมไอออนในสถานะก๊าซ ขั้นนี้ต้องใช้พลังงานหรือดูดพลังงาน 494 kJ/mol เรียกพลังงานที่ใข้ในขั้นนี้ว่า พลังงานไอออไนเซชั่น(Ionization Energy) สัญลักษณ์ "IE" หรือ "I"
Na(g)+494 kJ----------------->Na(g) + e.........(3)
4.คลอรีนอะตอมในสถานะก๊าซรับอิเลคตรอนกลายเป็นคลอไรด์ไอออนในสถานะก๊าซ(Cl-(g)) ขั้นนี้คายพลังงานออกมา 347 kJ/mol พลังงานที่คายออกมาในขั้นนี้เรียกว่า อิเลคตรอนอัฟฟินิตีหรือสัมพรรคภาพอิเลคตรอน (Electron Affinity) สัญลักษณ์ E หรือ EA
Cl(g)+e- -----------------> Cl-(g)+347 kJ...........(4)
5.โซเดียมไอออนในสถานะก๊าซ และคลอไรด์ไอออนในสถานะก๊าซรวมตัวกันด้วยพันธะไอออนิกได้ผลึกโซเดียมครอไรด์ (NaCl(s)) ขั้นนี้คายพลังงานออกมา 787 kJ/mol พลังงานที่คายออกมาในขั้นนี้เรียกว่าพลังงานแลคทิซ หรือพลังงานโครงร่างผลึก (Lattic Energy) สัญลักษณ์ U หรือ Ec
Na+(g) + Cl-(g) ---------------------->NaCl(s)+787 kJ.........(5)
เมื่อเอาสมการ (1)+(2)+(3)+(4)+(5) จะได้สมการรวมหรือปฏิกิริยารวมดังนี้
Na(s)+Cl(g)-----------------------> NaCl(s)+410 kJ..........(6)
แสดงว่าในการเกิด NaCl(s) เป็นการเปลี่ยนแปลงประเภทคายพลังงาน คือ เมื่อเกิด NaCl 1 mol จะคายพลังงานเท่ากับ 410 kJ
พลังงานที่คายออกมาเรียกว่า พลังงานของปฏิกิริยาหรือความร้อนของปฏิกิริยาหรือความร้อนของการเกิดสาร สัญลักษณ์ "Hf"
หมายเหตุ*** การเกิดสารประกอบไอออนิกอาจคายหรือดูดพลังงานก็ได้แต่มักจะคายพลังงาน
3.2.4 สมบัติของสารประกอบไอออนิก
1.มีขั้ว (Polar nature) สารประกอบไอออนิกไม่ได้เกิดขึ้นเป็นโมเลกุลเดี่ยว แต่จะเป็นของแข็งซึ่งประกอบด้วยไอออนจำนวนมากซึ่งยึดเหนี่ยวกันด้วยแรงยึดเหนี่ยวทางไฟฟ้า
2.นำไฟฟ้าได้ เมื่อใส่สารประกอบไอออนนิกลงในน้ำ ไอออนจะแยกออกจากัน ทำให้สารละลายนำไฟฟ้าได้ ในทำนองเดียวกัน สารประกอบที่หลอมเหลวจะนำไฟฟ้าได้ด้วย เนื่องจากเมื่อหลอมเหลวไอออนจะเป็นอิสระจากกัน เกิดการไหลเวียนอิเลคตรอน ทำให้อิเลคตรอนเคลื่อนที่จึงเกิดการนำไฟฟ้า
3.มีจุดหลอมเหลวและจุดเดือดสูง เพราะต้องการพลังงานความร้อนในการทำลายแรงดึงดูดระหว่างไอออนให้กลายเป็นของเหลวหรือกลายเป็นไอตามที่ต้องการ
4.การละลาย (Solubility) สารประกอบไอออนิกจะละลายในน้ำแต่ไม่ละลายในเบนซีนหรือตัวทำละลายอินทรีย์ น้ำและตัวทำละลายชนิดมีขั้วอื่น ๆ จะมีค่า dielectric constant สูง ซึ่งจะทำให้แรงดึงดูดไฟฟ้าที่ดึงดูดระหว่างไอออนอ่อนลง ทำให้ไอออนแยกจากกัน การประทะกัน (interaction) ระหว่างไอออนและโมเลกุลที่มีขั้ว (Polar nature) จึงช่วยในขบวนการ dissociation (disssociation เป็นขบวนการที่สารแตกตัวออกเป็นไอออนเมื่อละลายในน้ำ ตัวทำละลายอินทรีย์ มี dielectric constant ต่ำและมักเป็นสารประกอบที่ไม่มีขั้ว สารประกอบไอออนิกโดยทั่ว ๆ ไปจะไม่ละลายในตัวทำละลายที่ไม่มีขั้ว
5.สารประกอบไอออนิกทำให้เกิดปฏิกริยาไอออนิก คือ ปฏิกริยาระหว่างไอออนกับไอออน ทั้งนี้เพราะสารไอออนิกจะเป็นไอออนอิสระในสารละลาย ปฎิกริยาจึงเกิดทันที
6. สมบัติไม่แสดงทิศทางของพันธะไอออนิก สารประกอบไอออนิกเกิดจากไอออนที่มีประจุตรงกันข้าม
รอบ ๆ ไอออนแต่ละไอออนจะมีสนามไฟฟ้าซึ่งไม่มีทิศทาง จึงทำให้เกิดสมบัติไม่แสดงทิศทางของพันธะไอออนิก

3.2.5 สมการไอออนิกและสมการไอออนิกสุทธิ
เมื่อนำสารละลายไอออนิกคู่ใดคู่หนึ่งมาผสมกัน แล้วเกิดตะกอนขึ้น แสดงว่าเกิดปฏิกิริยาขึ้น ในการเกิดปฏิกิริยาในน้ำมักจะมีการแลกเปลี่ยนไอออนบวกและไอออนลบซึ่งกันและกัน ซึ่งเขียนเป็นสมการทั่วไปได้ดังนี้
AX + BY ————> AY + BX เช่น
การผสมสารละลายแคลเซียมไฮดรอกไซด์และโซเดียมคาร์บอเนต ได้ตะกอนสีขาวของแคลเซียมคาร์บอเนต แต่ Ca(OH)2, Na2CO3และ NaOH เมื่อละลายน้ำแล้วสามารถแตกตัวอย่างสมบูรณ์ คือ 

สมการที่แสดงไอออนอิสระของสารประกอบไอออนิกในสารละลายครบทุกชนิดเช่นนี้เรียกว่า สมการไอออนิก เนื่องจากในปฏิกิริยานี้มี OH- และ Na+ ปรากฏอยู่ทั้งสองด้านและไม่เกิดการเปลี่ยนแปลงในปฏิกิริยาจึงตัดออกไปได้ ส่วนไอออนที่ทำปฏิกิริยาแล้วได้ผลิตภัณฑ์คือ Ca2+ และ CO32-เท่านั้น ที่นำมาเขียนเป็นสมการ
ดังนั้นสมการไอออนิกสุทธิจะเป็นสมการเคมีที่เขียนเฉพาะไอออนและโมเลกุลที่เกี่ยวข้องในปฏิกิริยาเท่านั้น โดยผลรวมของประจุทางซ้ายและทางขวาของสมการต้องดุลกันพอดี
สรุปสมการไอออนิกจะเกิดได้ 3 ลักษณะดังนี้
1. การเกิดผลิตภัณฑ์ที่ไม่ละลายน้ำ เรียกว่า การตกตะกอน เช่น
จะได้ตะกอนของ PbI2(s) และ NaNO3 ที่ละลายน้ำได้ดี จึงมีไอออน Na+ และNO3- อยู่ในสารละลาย
เขียนเป็นสมการเชิงโมเลกุล
สรุปสมการไอออนิกจะเกิดได้ 3 ลักษณะดังนี้
1. การเกิดผลิตภัณฑ์ที่ไม่ละลายน้ำ เรียกว่า การตกตะกอน เช่น
จะได้ตะกอนของ PbI2(s) และ NaNO3 ที่ละลายน้ำได้ดี จึงมีไอออน Na+ และNO3- อยู่ในสารละลาย
เขียนเป็นสมการเชิงโมเลกุล
ขั้นตอนการเขียนสมการไอออนิกและสมการไอออนิกสุทธิ
1. เขียนสมการการแตกตัวเป็นไอออนในน้ำของสารตั้งต้นพร้อมทั้งดุลสมการ
2. จับคู่ไอออนบวกและไอออนลบที่มาจากสารตั้งต้นต่างชนิดกันเพื่อรวมตัวกันเป็นผลิตภัณฑ์
3. พิจารณาสมบัติการละลายน้ำของผลิตภัณฑ์ที่เกิดขึ้น ถ้าผลิตภัณฑ์ไม่ละลายน้ำจะต้องเขียนสูตรโมเลกุลในสมการ แต่ถ้าผลิตภัณฑ์ละลายน้ำ แสดงว่าผลิตภัณฑ์จะอยู่ในรูปของไอออนบวกและไอออนลบ
4. เขียนสมการไอออนิก โดยเขียนสูตรไอออนบวกและไอออนลบของสารตั้งต้นที่ทำให้เกิดผลิตภัณฑ์ที่ไม่ละลายน้ำ และเขียนสูตรโมเลกุลของผลิตภัณฑ์ที่ไม่ละลายน้ำด้วย
หมายเหตุ สารที่เขียนสูตรโมเลกุลในสมการไอออนิก จะต้องเป็นสารที่ไม่ละลายน้ำหรือมีสถานะเป็นก๊าซหรือไม่แตกตัวเป็นไอออน
Ex
Ca(OH)2 (aq) + Na2CO3 (aq) ----------> CaCO3 (s) + 2Na(OH) (aq)
Ca(aq) + 2OH(aq) + 2Na(aq) + CO3(aq) ----------> CaCO3(s) + 2OH(aq) + 2Na(aq)
3.3 พันธะโคเวเลนต์
พันธะโคเวเลนต์(Covalent bond) มาจากคำว่า co + valence electron ซึ่งหมายถึง พันธะที่เกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน ดังเช่น ในกรณีของไฮโดรเจน ดังนั้นลักษณะที่สำคัญของ พันธะโคเวเลนต์ก็คือการที่อะตอมใช้เวเลนต์อิเล็กตรอนร่วมกันเป็นคู่ ๆ
- สารประกอบที่อะตอมแต่ละคู่ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์ เรียกว่าสารโคเวเลนต์
- โมเลกุลของสารที่อะตอมแต่ละคู่ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์เรียกว่าโมเลกุลโคเวเลนต์
3.3.1การเกิดพันธะโคเวเลนต์
เนื่องจาก พันธะโคเวเลนต์ เกิดจากการใช้เวเลนต์อิเล็กตรอนร่วมกัน ซึ่งอาจจะใช้ร่วมกันเพียง 1 คู่ หรือมากกว่า 1 คู่ก็ได้
- อิเล็กตรอนคู่ที่อะตอมทั้งสองใช้ร่วมกันเรียกว่า “อิเล็กตรอนคู่ร่วมพันธะ”
- อะตอมที่ใช้อิเล็กตรอนร่วมกันเรียกว่าอะตอมคู่ร่วมพันธะ
* ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 2 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่าพันธะคู่เช่น ในโมเลกุลของออกซิเจน
* ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 3 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่าพันธะสามเช่น ในโมเลกุลของไฮโดรเจน
จากการศึกษาสารโคเวเลนต์จะพบว่า ธาตุที่จะสร้างพันธะโคเวเลนต์ส่วนมากเป็นธาตุอโลหะกับอโลหะ ทั้งนี้เนื่องจากโลหะมีพลังงานไอออไนเซชันค่อนข้างสูง จึงเสียอิเล็กตรอนได้ยาก เมื่ออโลหะรวมกันเป็นโมเลกุลจึงไม่มีอะตอมใดเสียอิเล็กตรอน มีแต่ใช้อิเล็กตรอนร่วมกันเกิดเป็นพันธะโคเวเลนต์ อย่างไรก็ตามโลหะบางชนิดก็สามารถเกิดพันธะโคเวเลนต์กับอโลหะได้ เช่น Be เกิดเป็นสารโคเวเลนต์คือ BeCl2เป็นต้น

ชนิดของพันธะโคเวเลนต์ พิจารณาจากจำนวนอิเล็กตรอนที่ใช้ร่วมกันของอะตอมคู่ร่วมพันธะ ดังนี้
ก. พันธะเดี่ยวเป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมคู่สร้างพันธะทั้งสองใช้อิเล็กตรอนร่วมกัน 1 คู่ ใช้เส้น ( - ) แทนพันธะเดี่ยว เช่น

ข. พันธะคู่เป็นพันธะโคเวเลนต์ที่เกิดจากอะตอมคู่สร้างพันธะทั้งสองใช้อิเล็กตรอนร่วมกัน 2 คู่ ใช้เส้น 2 เส้น ( = ) แทน 1 พันธะคู่ เช่นพันธะระหว่าง O ใน O2, O กับ C ใน CO2, C กับ H ใน C2H4

3.3.2 สูตรโมเลกุลและชื่อของสารโคเวเลนต์
การเขียนสูตรสารประกอบโคเวเลนต์
1. ให้เรียงลำดับธาตุให้ถูกต้องตามหลักสากล ดังนี้คือ Si , C , Sb , As , P , N , H , Te , Se , S , At , I , Br , Cl , O , F ตามลำดับ
2. ในสารประกอบโคเวเลนต์ ถ้าอะตอมของธาตุมีจำนวนอะตอมมากกว่าหนึ่งให้เขียนจำนวนอะตอมด้วยตัวเลขแสดงไว้มุมล่างทางขวา ในกรณีที่ธาตุในสารประกอบนั้นมีเพียงอะตอมเดียวไม่ต้องเขียนตัวเลขแสดงจำนวนอะตอม
3. หลักการเขียนสูตรสารประกอบโคเวเลนต์ที่มีอะตอมของธาตุจัดเวเลนต์อิเล็กตรอน เป็นไปตามกฎออกเตต ใช้จำนวนอิเล็กตรอนคู่ร่วมพันธะของแต่ละอะตอมของธาตุคูณไขว้ เช่น
สูตรของสารประกอบของธาตุ H กับ S ; H และ S มีเวเลนต์อิเล็กตรอน 1 และ 6 ตามลำดับ ดังนั้น H และ S ต้องการอิเล็กตรอนคู่ร่วมพันธะจำนวน 1 และ 2 ตามลำดับ เพื่อให้แต่ละอะตอมของธาตุมีการจัดอิเล็กตรอนแบบก๊าซเฉื่อย


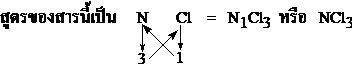
ข. การเรียกชื่อสารประกอบโคเวเลนต์
1.สารประกอบของธาตุคู่ ให้อ่านชื่อธาตุที่อยู่ข้างหน้าก่อนแล้ว ตามด้วยชื่อธาตุที่อยู่หลังโดยเปลี่ยนเสียงพยางค์ท้ายเป็น ไอด์ ( ide)
2. ให้ระบุจำนวนอะตอมของแต่ละธาตุด้วยเลขจำนวนในภาษากรีกดังนี้
1 = mono- (มอนอ) 2 = di- (ได)
3 = tri- (ไตร) 4 = tetra- (เตตระ)
5 = penta- (เพนตะ) 6 = hexa- (เฮกซะ)
7 = hepta- (เฮปตะ) 8 = octa- (ออกตะ)
9 = mona- (โมนะ) 10 = deca- (เดคะ)
3. ถ้าสารประกอบนั้น อะตอมของธาตุแรกมีเพียงอะตอมเดียวไม่ต้องระบุจำนวนอะตอมของธาตุนั้น แต่ถ้าเป็นธาตุข้างหลังในสารประกอบ ถึงแม้มีเพียงหนึ่งอะตอมก็ต้องระบุจำนวนอะตอมด้วยคำว่า “มอนอ” เสมอ เช่น
N2O3อ่านว่า ไดไนโตรเจนไตรออกไซด์
PCl5อ่านว่า ฟอสฟอรัสเพนตะคลอไรด์
CO อ่านว่า คาร์บอนมอนอกไซด์
P2O5อ่านว่า ไดฟอสฟอรัสเพนตะออกไซด์
การเขียนสูตรเคมีสูตรเคมี หมายถึงสัญลักษณ์ที่ใช้เพื่อแสดงว่าสารประกอบนั้นมีธาตุอะไรบ้างเป็นองค์ประกอบอย่างละกี่อะตอม สูตรเคมีแบ่งออกเป็น 3 ประเภทคือ
1. สูตรโมเลกุลเป็นสูตรเคมีที่แสดงให้ทราบว่าสารนั้นประกอบด้วยธาตุอะไรบ้างอย่างละกี่อะตอม เช่น สูตรโมเลกุลของน้ำตาลกลูโคส คือ C6H12O6แสดงว่ากลูโคสประกอบด้วยธาตุ C , H และ O จำนวน 6 , 12 และ 6 อะตอมตามลำดับ
สำหรับสูตรโมเลกุล ของสารโคเวเลนต์โดยทั่วไป จะเขียนสัญลักษณ์ของธาตุในโมเลกุล เรียงลำดับคือ B , Si, C , P , H , S , I , Sr , Cl , O และ F เช่น ClF OF2, CO2เป็นต้น
2. สูตรอย่างง่ายเป็นสูตรเคมีที่แสดงให้ทราบว่าสารนั้นประกอบด้วยธาตุอะไรบ้าง มีอัตราส่วนของจำนวนอะตอมเป็นเท่าใด เช่น สูตรอย่างง่ายของกลูโคสคือ CH2O ซึ่งแสดงว่ากลูโคสประกอบด้วยธาตุ C, H และ O โดยมีอัตราส่วนอะตอมของ C : H : O = 1: 2 : 1
3. สูตรโครงสร้างเป็นสูตรเคมีที่แสดงให้ทราบว่าสารนั้นประกอบด้วยธาตุอะไรบ้าง อย่างละกี่อะตอมและแต่ละอะตอมยึดเหนี่ยวกันด้วยพันธะเคมีอย่างไร สูตรโครงสร้างของสารให้รายละเอียดเกี่ยวกับองค์ประกอบของธาตุต่าง ๆ ในโมเลกุลมากกว่าสูตรอย่างง่ายและสูตรโมเลกุล
สูตรโครงสร้างสามารถเขียนได้ 2 แบบคือ สูตรโครงสร้างแบบจุด (electron dot formula) หรือสูตรโครงสร้างแบบลิวอิส (Lewis formula) และสูตรโครงสร้างแบบเส้น (graphic formula) สูตรโครงสร้างทั้ง 2 แบบจะแสดงเฉพาะเวเลนต์อิเล็กตรอนของอะตอมคู่ร่วมพันธะ
ก. สูตรโครงสร้าง
ใช้สัญลักษณ์เป็นจุด ( . ) แทนเวเลนต์อิเล็กตรอนโดยเขียนไว้รอบ ๆ สัญลักษณ์ของธาตุ หรืออาจจะใช้สัญลักษณ์เป็น x แทนเวเลนต์อิเล็กตรอนก็ได้เพื่อให้เห็นความแตกต่างระหว่างอิเล็กตรอนของธาตุคู่ร่วมพันธะต่างชนิดกัน
โดยทั่ว ๆ ไปการเขียนสูตรแบบจุดจะมีข้อกำหนดดังนี้
1. อะตอมของธาตุก่อนเขียน ให้เขียนแยกกัน และเขียนจุด ( . ) แสดงเวเลนต์อิเล็กตรอนล้อมรอบสัญลักษณ์ของธาตุ โดยมีจำนวนจุดเท่ากับจำนวนเวเลนต์อิเล็กตรอน เช่น
1H มี 1 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดเป็น

8O มี 6 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดเป็น

15P มี 5 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดเป็น 

ตัวอย่างเช่น
1. สูตรแบบจุดของไฮโดรเจน (H2)
1H มี 1 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดได้เป็น เมื่อ 2 อะตอมรวมกันเป็นโมเลกุล จะมีการใช้เวเลนต์อิเล็กตรอนร่วมกัน 1 คู่ จึงเขียนสูตรแบบจุดได้ดังนี้

2. สูตรแบบจุดของก๊าซไฮโดรเจนฟลูออไรด์ (HF)
9F มีการจัดเรียงอิเล็กตรอนเป็น 2 , 7ดังนั้นมี 7 เวเลนต์อิเล็กตรอน สูตรแบบจุดคือ
เมื่อ H รวมกับ F เป็น HF เขียนเป็นสูตรแบบจุดได้ดังนี้

H และ F ใช้อิเล็กตรอนร่วมกันเพียง 1 คู่ในโมเลกุลของ HF จึงมีพันธะโคเวเลนต์เพียง 1 พันธะ โดยเขียนอิเล็กตรอนที่ใช้ร่วมกันไว้ระหว่างธาตุ H กับ F สำหรับอิเล็กตรอนที่เหลือของ F 6 อิเล็กตรอนก็เขียนไว้บนอะตอมของ F
3. สูตรแบบจุดของก๊าซไฮโดรเจนซัลไฟด์ (H2S)
กำมะถันมีเลขอะตอมเท่ากับ 16
เพราะฉะนั้นมีการจัดเรียงอิเล็กตรอนเป็น 2 , 8 , 6
16S จึงมี 6 เวเลนต์อิเล็กตรอน สูตรแบบจุดคือ 

เมื่อ H รวมกับ S เป็น H2S เขียนสูตรแบบจุดได้เป็นดังนี้
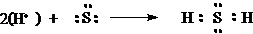
ในโมเลกุลของ H2S มีการใช้อิเล็กตรอนร่วมกันระหว่าง H กับ S 2 คู่ ดังนั้นในโมเลกุลของ H2S จึงมีพันธะโคเวเลนต์ 2 พันธะ อิเล็กตรอนที่ใช้ร่วมกันทั้ง 2 คู่เขียนไว้ระหว่างอะตอมของ H กับ S ส่วนอิเล็กตรอนที่เหลือของ S 4 อิเล็กตรอนให้เขียนไว้บนอะตอมของ S
4. สูตรแบบจุดของก๊าซแอมโมเนีย (NH3)
ไนโตรเจนเป็นธาตุหมู่ที่ 5 มีเลขอะตอมเท่ากับ 7
เพราะฉะนั้นมีการจัดเรียงอิเล็กตรอนเป็น 2 , 5
7N จึงมี 5 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดได้ดังนี้ 

เมื่อ N รวมกับ H เป็น NH3เขียนสูตรแบบจุดได้ดังนี้

5. สูตรแบบจุดของฟอสฟอรัสไตรคลอไรด์ (PCl3)
P มีเลขอะตอมเท่ากับ 15
เพราะฉะนั้น P มีการจัดเรียงอิเล็กตรอนเป็น 2 , 8 , 5
15P จึงมี 5 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดได้เป็น
Cl มีเลขอะตอมเท่ากับ 17
เพราะฉะนั้น Cl มีการจัดเรียงอิเล็กตรอนเป็น 2 , 8 , 7
17Cl จึงมี 7 เวเลนต์อิเล็กตรอน เขียนสูตรแบบจุดได้เป็น 

เมื่อ Cl 3 อะตอม รวมตัวกับ P 1 อะตอม เกิดเป็นสารประกอบโคเวเลนต์ PCl3จะเขียนสูตรแบบจุดได้ดังนี้

ข. สูตรโครงสร้างแบบเส้น
เป็นการเขียนสูตรโครงสร้างของโมเลกุลโคเวเลนต์อีกแบบหนึ่งซึ่งแตกต่างจากสูตรแบบจุดเล็กน้อย โดยกำหนดให้ใช้เส้นตรง ( - ) แทนอิเล็กตรอนคู่ร่วมพันธะ 1 คู่ หรือแทนพันธะโคเวเลนต์ 1 พันธะ ทั้งนี้ให้เขียนไว้ในระหว่างสัญลักษณ์ของธาตุคู่ร่วมพันธะ สำหรับอิเล็กตรอนที่ไม่ใช่อิเล็กตรอนคู่ร่วมพันธะจะเขียนไว้หรือไม่เขียนก็ได้ (ปกติจะไม่เขียน) สูตรแบบเส้นจึงเป็นการกำหนดขึ้นมาเพื่อให้เขียนสูตรโครงสร้างได้สะดวก และง่ายขึ้น ทั้งนี้เพราะไม่จำเป็นต้องแสดงเวเลนต์อิเล็กตรอนทั้งหมดของธาตุคู่ร่วมพันธะ
ให้ใช้เส้นตรง 1 เส้น ( - ) แทนอิเล็กตรอนที่ใช้ร่วมกัน 1 คู่
ให้ใช้เส้นตรง 2 เส้น ( = ) แทนอิเล็กตรอนที่ใช้ร่วมกัน 2 คู่
ให้ใช้เส้นตรง 3 เส้น ( ) แทนอิเล็กตรอนที่ใช้ร่วมกัน 3 คู่
ตัวอย่างสูตรแบบเส้น
1. สูตรแบบเส้นของก๊าซไฮโดรเจน (H2)
สูตรแบบจุดของ H2คือ H : H
จะเห็นได้ว่า H ทั้งสองอะตอมใช้อิเล็กตรอนร่วมกัน 1 คู่จึงใช้เส้นตรง 1 เส้นเขียนแทนอิเล็กตรอนคู่ร่วมพันธะ โดยเขียนไว้ระหว่าง H ทั้งสองอะตอม
เพราะฉะนั้นสูตรโครงสร้างแบบเส้นของ H2จึงเป็น H - H
2. สูตรโครงสร้างแบบเส้นของก๊าซไฮโดรเจนฟลูออไรด์ (HF)
สูตรแบบจุดของ HF คือ 

จะเห็นได้ว่าอะตอม H กับ F มีการใช้อิเล็กตรอนร่วมกันเพียง 1 คู่ จึงใช้เส้นตรง 1 เส้นแทนอิเล็กตรอนคู่ร่วมพันธะ
เพราะฉะนั้นสูตรแบบเส้นของ HF จึงเป็น H - F
3. สูตรแบบเส้นของก๊าซไฮโดรเจนซัลไฟด์ (H2S)
สูตรแบบจุดของ H2S คือ 

จะเห็นได้ว่า H และ S ใช้อิเล็กตรอนร่วมกัน 1 คู่จึงใช้เส้นตรง 1 เส้นแทนอิเล็กตรอนคู่ร่วมพันธะ 1 คู่
ในโมเลกุลของ H2S จึงมี 2 พันธะโคเวเลนต์
เพราะฉะนั้น สูตรแบบเส้นของ H2S คือ H - S – H
4.สูตรแบบเส้นของก๊าซแอมโมเนีย (NH3)
สูตรแบบจุดของ NH3คือ 

เพราะฉะนั้นสูตรแบบเส้น ของ NH3จึงเป็น

5. สูตรแบบเส้นของฟอสฟอรัสไตรคลอไรด์ (PCl3)
สูตรแบบจุดคือ 

เพราะฉะนั้นเขียนสูตรแบบเส้นได้เป็น 

หมายเหตุ***
ก. การเขียนสูตรโครงสร้างแสดงพันธะโคเวเลนต์ทั้ง 2 แบบไม่ได้แสดงตำแหน่งที่แน่นอนของอิเล็กตรอน
ข. การเขียนสูตรโครงสร้างทั้งสองแบบนี้ ไม่ได้แสดงตำแหน่งของพันธะหรือตำแหน่งที่แน่นอนของอิเล็กตรอน รวมทั้งไม่ได้แสดงโครงสร้างของโมเลกุล
3.3.3 ความยาวพันธะและพลังงานพันธะของสารโคเวเลนต์
พลังงานพันธะ หมายถึง พลังงานที่น้อยที่สุดที่ใช้เพื่อสลายพันธะที่ยึดเหนี่ยวระหว่างอะตอมคู่หนึ่งๆในโมเลกุลในสถานะแก๊ส พลังงานพันธะสามารถบอกถึงความแข็งแรงของพันธะเคมีได้ โดยพันธะที่แข็งแรงมากจะมีพลังงานพันธะมาก และพันธะที่แข็งแรงน้อยจะมีพลังงานพันธะน้อย
พลังงานพันธะเฉลี่ย หมายถึง ค่าพลังงานเฉลี่ยของพลังงานสลายพันธะ ของอะตอมคู่หนึ่งๆ ซึ่งเฉลี่ยจากสารหลายชนิด เช่น การสลายโมเลกุลมีเทน (CH4) ให้กลายเป็นอะตอมคาร์บอนและไฮโดรเจน มีสมการและค่าพลังงานที่เกี่ยวข้องดังนี้

 จากหัวข้อการเกิดพันธะโคเวเลนต์ นักเรียนทราบแล้วว่าอะตอมไฮโดรเจน 2 อะตอมเข้าใกล้กันเป็นระยะทาง 0.74 อังสตรอม (หรือ 74 พิโคเมตร) ซึ่งเป็นระยะทางที่เหมาะสมในการเกิดพันธะโคเวเลนต์ระหว่างไฮโดรเจน โดยระยะนี้เรียกว่า "ความยาวพันธะ" โดยปกติแล้วเราสามารถหาความยาวพันธะของสารได้จากการศึกษาการเลี้ยวเบนของรังสีเอ็กซ์ (X-ray diffraction ; XRD) ผ่านผลึกของสาร ทั้งนี้ความยาวพันธะระหว่างอะตอมคู่เดียวกันในโมเลกุลของสารต่างชนิดกัน จะมีค่าไม่เท่ากัน เช่น
จากหัวข้อการเกิดพันธะโคเวเลนต์ นักเรียนทราบแล้วว่าอะตอมไฮโดรเจน 2 อะตอมเข้าใกล้กันเป็นระยะทาง 0.74 อังสตรอม (หรือ 74 พิโคเมตร) ซึ่งเป็นระยะทางที่เหมาะสมในการเกิดพันธะโคเวเลนต์ระหว่างไฮโดรเจน โดยระยะนี้เรียกว่า "ความยาวพันธะ" โดยปกติแล้วเราสามารถหาความยาวพันธะของสารได้จากการศึกษาการเลี้ยวเบนของรังสีเอ็กซ์ (X-ray diffraction ; XRD) ผ่านผลึกของสาร ทั้งนี้ความยาวพันธะระหว่างอะตอมคู่เดียวกันในโมเลกุลของสารต่างชนิดกัน จะมีค่าไม่เท่ากัน เช่น
CH4(g) + 435 kJ → CH3(g) + H(g)
CH3(g) + 453 kJ → CH2(g) + H(g)
CH2(g) + 425 kJ → CH(g) + H(g)
CH(g) + 339 kJ → C(g) + H(g)
เราจะเห็นได้ว่าการสลายพันธะระหว่าง C-H ในแต่ละพันธะของโมเลกุลมีเทน (CH4) จะใช้พลังงานไม่เท่ากัน ดังนั้น เมื่อนำค่าพลังงานทุกค่ามาเฉลี่ย ก็จะได้เป็นค่าพลังงานพันธะเฉลี่ยนั่นเอง ดังแสดงในตาราง

ความยาวพันธะ หมายถึง ระยะระหว่างจุดศูนย์กลางของนิวเคลียสของอะตอมทั้งสองที่เกิดพันธะกัน (หน่วยเป็น Angstrom , 10-10 m , A0 )

สาร
|
สูตรโมเลกุล
|
ความยาวพันธะ O-H (pm)
|
น้ำ
|
H2O
|
95.8
|
เมทานอล
|
CH3OH
|
95.6
|
ดังนั้น ความยาวพันธะระหว่างอะตอมคู่หนึ่ง จึงหาได้จากค่าเฉลี่ยของความยาวพันธะระหว่างอะตอมคู่เดียวกันในโมเลกุลต่างๆ เมื่อกล่าวถึงความยาวพันธะ โดยทั่วไปจึงหมายถึง “ความยาวพันธะเฉลี่ย”

ความยาวพันธะและพลังงานพันธะ จะสามารถเปรียบเทียบกันได้ก็ต่อเมื่อเป็นพันธะที่เกิดจากอะตอมของธาตุคู่เดียวกัน ถ้าเป็นอะตอมต่างคู่กันเทียบกันไม่ได้ เช่น

1. ความยาวพันธะ พันธะเดี่ยว > พันธะคู่ > พันธะสาม
2. พลังงานพันธะ พันธะสาม > พันธะคู่ > พันธะเดี่ยว
3.3.4 รูปร่างโมเลกุลโคเวเลนต์
โมเลกุลโควาเลนต์ในสามมิตินั้น สามารถพิจารณาได้จากการผลักกันของอิเล็กตรอนที่มีอยู่รอบๆ อะตอมกลางเป็นสำคัญ โดยอาศัยหลักการที่ว่า อิเล็กตรอนเป็นประจุลบเหมือนๆ กัน ย่อมพยายามที่แยกตัวออกจากกนให้มากที่สุดเท่าที่จะกระทำได้ ดังนั้นการพิจารณาหาจำนวนกลุ่มของอิเล็กตรอนที่อยู่รอบๆ นิวเคลียสและอะตอมกลาง จะสามารถบ่งบอกถึงโครงสร้างของโมเลกุลนั้น ๆ ได้ โดยที่กลุ่มต่างๆ มีดังนี้- อิเล็กตรอนคู่โดดเดี่ยว
- อิเล็กตรอนคู่รวมพันธะได้แก่ พันธะเดี่ยว พันธะคู่ และพันธะสามทั้งนี้โดยเรียงตามลำดับความสารารถในการผลักอิเลคตรอนกลุ่มอื่นเนื่องจาก อิเลคตรอนโดดเดี่ยวและอิเลคตรอนที่สร้างพันธะนั้นต่างกันตรงที่อิเล็กตรอน โดยเดี่ยวนั้นถูกยึดด้วยอะตอมเพียงตัวเดียว ในขณะที่อิเล็กตรอนที่ใช้สร้างพันธะถูกยึดด้วยอะตอม 2 ตัวจึงเป็นผลให้อิเลคตรอนโดดเดี่ยวมีอิสระมากกว่าสามารถครองพื้นที่ในสามมิ ตได้มากกว่า ส่วนอิเล็กตรอนเดี่ยวและอิเล็กตรอนคู่โดดเดี่ยว รวมไปถึงอิเล็กตรอนคู่ร่วมพันธะแบบต่าง ๆ นั้นมีจำนวนอิเลคตรอนไม่เท่ากันจึงส่งผลในการผลักอิเลคตรอนกลุ่มอื่นๆ ได้มีเท่ากัน โครงสร้างที่เกิดจกการผลักกันของอิเล็กตรอนนั้น สามารถจัดเป็นกลุ่มได้ตามจำนวนของอิเล็กรอนที่มีอยู่ได้ตั้งแต่ 1 กลุ่ม 2 กลุ่ม 3 กลุ่ม ไปเรื่อยๆ เรียกวิธีการจัดตัวแบบนี้ว่า ทฤษฎีการผลักกันของคู่อิเล็กตรอนวงนอก (Valence Shell Electron Pair Repulsion : VSEPR) ดังภาพ
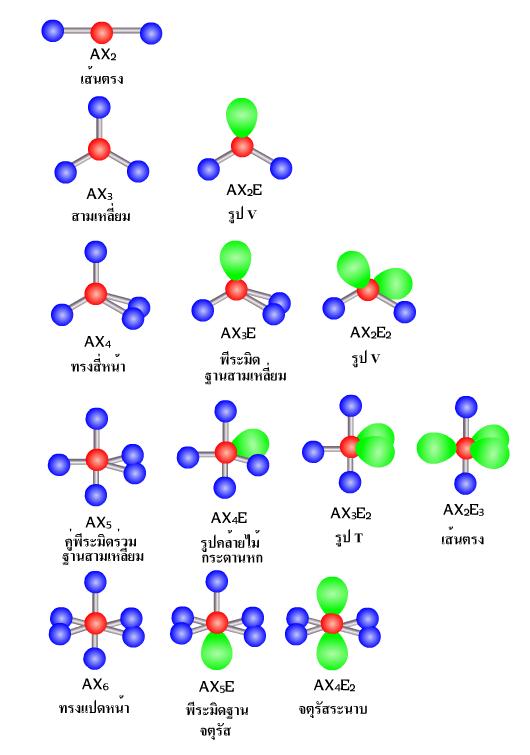 |
| ภาพแสดงรูปร่างโครงสร้างโมเลกุลโควาเลนต์แบบต่างๆ ตามทฤษฎี VSEPR |
X คือ จำนวน อิเล็กตรอนคู่รวมพันธะ (สีน้ำเงิน)
E คือ จำนวนอิเล็กตรอนคู่โดดเดี่ยว (สีเขียว)
3.3.5 สภาพขั้วของโมเลกุลโคเวเลนต์
 |
| อิเล็กตรอนถูกดึงดูดเท่า ๆ กัน |
 |
ธาตุที่มีจำนวนประจุในนิวเคลียสมาก แต่มีระยะระหว่างเวเลนต์อิเล็กตรอนกับนิวเคลียสห่างกันน้อยจะมีค่าอิเล็กโทรเนกาติวิตีสูงกว่าธาตุที่มีระยะระหว่างเวเลนต์อิเล็กตรอนกับนิวเคลียสห่างกันมาก
- อะตอมที่มีค่าอิเล็กโทรเนกาติวิตีสูง มีแนวโน้มที่จะแสดงอำนาจไฟฟ้าลบ
- อะตอมที่มีค่าอิเล็กโทรเนกาติวิตีต่ำ มีแนวโน้มที่จะแสดงอำนาจไฟฟ้าบวก
1. เป็นพันธะโคเวเลนต์ที่เกิดกับคู่อะตอมของธาตุชนิดเดียวกัน
2. เป็นพันธะโคเวเลนต์ที่มีการกระจายอิเล็กตรอนให้แต่ละอะตอมเท่ากัน
3. พันธะโคเวเลนต์ไม่มีขั้วอาจจะเกิดกับพันธะโคเวเลนต์ชนิดพันธะเดี่ยว เช่น Cl - Cl พันธะโคเวเลนต์ชนิดพันธะคู่ เช่น O = O และพันธะโคเวเลนต์ชนิดพันธะสาม เช่น N N
4. พันธะโคเวเลนต์ที่ไม่มีขั้วเกิดในโมเลกุลใดเรียกว่า โมเลกุลไม่มีขั้ว (non- polar molecule)
ลักษณะสำคัญของพันธะโคเวเลนต์มีขั้ว
1. พันธะโคเวเลนต์มีขั้วเกิดกับคู่อะตอมของธาตุต่างชนิดกันที่มีค่าอิเล็กโทรเนกาติวิตีต่างกัน
2. เป็นพันธะโคเวเลนต์ที่มีการกระจายอิเล็กตรอนในแต่ละอะตอมไม่เท่ากัน
3. พันธะโคเวเลนต์มีขั้วเกิดในโมเลกุลใด โมเลกุลนั้นจะมีขั้วหรืออาจจะไม่มีขั้วก็ได้ แต่ถ้าพันธะโคเวเลนต์มีขั้ว เกิดในโมเลกุลที่มีเพียง 2 อะตอม โมเลกุลนั้นต้องเป็นโมเลกุลมีขั้วเสมอ
เขียนสัญลักษณ์แสดงขั้วของพันธะ
ใช้เครื่องหมาย อ่านว่า เดลตา โดยกำหนดให้ว่า พันธะมีขั้วใดที่อะตอมแสดงอำนาจไฟฟ้าลบ (เป็นอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีสูง) ใช้เครื่องหมายแทนด้วย และพันธะโคเวเลนต์มีขั้วใดที่อะตอมแสดงอำนาจไฟฟ้าบวก (เป็นอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีต่ำ ) ใช้เครื่องหมายแทนด้วย เช่น HF และ ClF

สภาพขั้วของพันธะโคเวเลนต์ (Polarity of covalent bond) คือ ความแรงของขั้วของพันธะโคเวเลนต์ กล่าวคือ พันธะโคเวเลนต์ใดที่มีอะตอมของธาตุทั้งสองมีผลต่างของค่าอิเล็กโตรเนกาติวิตีมาก ขั้วของพันธะโคเวเลนต์มีขั้วนั้นจะมีอำนาจขั้วไฟฟ้ามาก คือ มีสภาพขั้วแรง ส่วนพันธะโคเวเลนต์ใดที่มีอะตอมของธาตุทั้งสองมีผลต่างของค่าอิเล็กโตรเนกาติวิตีน้อย ขั้วของพันธะโคเวเลนต์มีขั้วนั้นจะมีอำนาจไฟฟ้าน้อย คือ มีสภาพขั้วต่ำ เช่น
HCl H มี EN = 2.20 Cl มี EN = 3.16
ผลต่างของค่า EN ของอะตอม H กับ Cl = 3.16 - 2.20 = 0.96
FCl F มี EN = 3.98 Cl มี EN = 3.16
ผลต่างของค่า EN ของอะตอม F กับ Cl = 3.98 - 3.16 = 0.82จะเห็นได้ว่าผลต่างของค่า EN ที่เกิดจากธาตุของพันธะ H - Cl มากกว่าของพันธะ F - Cl ดังนั้นขั้วของพันธะ H - Cl มีสภาพขั้วแรงกว่า ขั้วของพันธะ F - Cl
การเปรียบเทียบสภาพขั้วของพันธะระหว่างอะตอม พิจารณาได้จากผลต่างของค่าอิเล็กโตรเนกาติวิตีดังนี้
ขั้วของโมเลกุล
จากความรู้เรื่องพันธะโเวเลนต์มีขั้ว และพันธะโคเวเลนต์ไม่มีขั้วสามารถนำมาแบ่งประเภทของโมเลกุลโคเวเลนต์ได้เป็นโมเลกุลมีขั้ว และโมเลกุลไม่มีขั้ว แต่โมเลกุลโคเวเลนต์ใดจะเป็นโมเลกุลมีขั้ว หรือ ไม่มีขั้วนั้นสามารถพิจารณาได้ดังนี้
ก. โมเลกุลที่มีเพียง 2 อะตอม
- ถ้าโมเลกุลโคเวเลนต์ใดมีเพียง 2 อะตอม และเป็นอะตอมของธาตุชนิดเดียวกัน พันธะที่เกิดขึ้นในโมเลกุลเป็นพันธะโคเวเลนต์ไม่มีขั้ว ดังนั้น โมเลกุลก็จะเป็นโมเลกุลไม่มีขั้วด้วย เช่น H2, O2, N2
- ถ้าโมเลกุลโคเวเลนต์ใดมีเพียง 2 อะตอม และเป็นอะตอมของธาตุต่างชนิดกัน พันธะที่เกิดขึ้นในโมเลกุลเป็นพันธะโคเวเลนต์มีขั้ว ดังนั้นโมเลกุลก็จะเป็นโมเลกุลมีขั้วด้วย เช่น HCl , ClF , HI
ข. โมเลกุลที่มี 3 อะตอมหรือมากกว่า
ถ้าโมเลกุลที่เกิดจากพันธะมีขั้ว และมีรูปร่างของโมเลกุลสมมาตร โมเลกุลนั้นจะเป็นโมเลกุลไม่มีขั้ว เพราะมีผลรวมของทิศทางของแรงดึงดูดอิเล็กตรอนทั้งหมดในโมเลกุลเป็นศูนย์ เช่น

3.3.6 แรงยึดเหนี่ยวระหว่างโมเลกุลและสมบัติของสารประกอบโคเวเลนต์
ความหมายของแรงยึดเหนี่ยว
สารในธรรมชาติส่วนใหญ่จะไม่อยู่ในอิสระโดดๆ แต่อยู่รวมกันเป็นกลุ่มเป็นก้อนเช่นในของแข็งและของเหลวสามารถรวมกันอยู่เป็นกลุ่มก้อนแสดงว่าอะตอมเหล่านั้นมีแรงยึดเหนี่ยวต่อกัน ถ้าต้องการแยกสารที่อยู่รวมกันออกจากกัน เช่น การแยกก้อนหินออกเป็นก้อนเล็กๆ ต้องใช้พลังงานโดยใช้แรงทุบหรือนำไปเผาไฟ การแยกสารเคมีออกจากกันจะใช้พลังงานหรือไม่ จะเห็นได้ว่า การแยกสารออกจากกันนั้นต้องใช้พลังงานและการที่อะตอมสามารถรวมกันเป็นโมเลกุลเมื่อต้องการให้สลายตัวกลับมาเป็นอะตอมจะต้องใช้พลังงานจำนวนหนึ่งซึ่งเมื่อต้องการทำให้แยกออกจากกันจะต้องใช้พลังงานจำนวนหนึ่งดังนั้น อนุภาคภายในของสารจะต้องมีแรงยึดเหนี่ยวซึ่งกันและกัน โดยแรงยึดเหนี่ยวระหว่างของแข็งนั้นจะมากกว่าของเหลวและก๊าซ
พันธะเคมี(Chemical bond) หมายถึง แรงยึดเหนี่ยวระหว่างอะตอมเพื่อให้อยู่ในโมเลกุล หรือแรงยึดเหนี่ยวระหว่างโมเลกุลเพื่อทำให้อยู่กันเป็นก้อน
คำว่า พันธะ มาจาก Bond ซึ่งหมายถึง แรงยึดเหนี่ยว ดังนั้นเมื่อกล่าวถึงพันธะเคมีก็จะศึกษาถึงแรงยึดเหนี่ยวในทางเคมีนั่นเอง ซึ่งอาจจะเป็นแรงยึดเหนี่ยวระหว่างอะตอมด้วย และยังรวมถึงแรงยึดเหนี่ยวระหว่างโมเลกุลด้วยกันให้เป็นกลุ่มก้อน
คำว่า พันธะ มาจาก Bond ซึ่งหมายถึง แรงยึดเหนี่ยว ดังนั้นเมื่อกล่าวถึงพันธะเคมีก็จะศึกษาถึงแรงยึดเหนี่ยวในทางเคมีนั่นเอง ซึ่งอาจจะเป็นแรงยึดเหนี่ยวระหว่างอะตอมด้วย และยังรวมถึงแรงยึดเหนี่ยวระหว่างโมเลกุลด้วยกันให้เป็นกลุ่มก้อน
สาเหตุที่มีการสร้างพันธะหรือแรงยึดเหนี่ยว
จากความรู้เรื่องธาตุหมู่ 8A (ก๊าซเฉื่อย) จัดเป็นธาตุที่เฉื่อยต่อการเกิดปฏิกิริยากับธาตุอื่นๆ ที่เป็นเช่นนี้เพราะก๊าซเฉื่อยมีการจัดเรียงอิเล็กตรอนในวงนอกสุดเป็น 8 (ยกเว้น He เป็น 2) ทำให้โครงสร้างอะตอมของก๊าซเฉื่อยเสถียร มีพลังงานต่ำ ดังนั้นในการสร้างพันธะเคมีของอะตอมของธาตุอื่นๆ จึงพยายามที่จะทำให้ตัวเองเสถียรเหมือนก๊าซเฉื่อย โดยอาจจะมีการจ่าย เวเลนซ์อิเล็กตรอนออกไปหรือรับอิเล็กตรอนเพิ่มเข้ามา หรือนำเอาเวเลนซ์อิเล็กตรอนมาใช้ร่วมกับอะตอมอื่น ทั้งนี้เพื่อทำให้ เวเลนซ์อิเล็กตรอนครบ 8 ซึ่งเป็นไปตามกฎที่ใช้สร้างพันธะเคมี เรียกกฎนี้ว่า“กฎออกเตต”(Octet rule)
1.อะตอมให้อิเล็กตรอนในชั้นพลังงานนอกสุด (เวเลนซ์อิเล็กตรอน) แก่อะตอมอื่น
- 2. อะตอมรับอิเล็กตรอนในชั้นพลังงานนอกสุดของอะตอมเข้าสู่ชั้นนอกสุดของตัวเอง
- 3. อะตอมใช้อิเล็กตรอนในชั้นพลังงานนอกสุดร่วมกันกับอิเล็กตรอนในชั้นพลังงานนอกสุดของอะตอมอื่น ซึ่งทำให้เกิดแรงยึดเหนี่ยวระหว่างอะตอมของธาตุแล้ว ยังสามารถเกิดแรงยึดเหนี่ยวระหว่างโมเลกุลของสารได้ด้วย
แรงยึดเหนี่ยวของสารมี 2 ประเภท
1. แรงยึดเหนี่ยวระหว่างโมเลกุลการทำให้สารเปลี่ยนแปลงจะต้องใช้พลังงานจำนวนหนึ่ง ซึ่งจะมากหรือน้อยขึ้นอยู่กับชนิดของสาร ข้อมูลที่ยืนยันว่าสารมีแรงยึดเหนี่ยวระหว่างโมเลกุล ได้แก่ จุดเดือด จุดหลอมเหลว ความร้อนแฝง การที่ต้องใช้พลังงานจำนวนหนึ่งทำให้ของแข็งเป็นหลอมเหลวหรือเปลี่ยนสถานะจากของแข็ง ของเหลว การที่จะให้ของเหลวเดือดหรือเปลี่ยนแปลงสถานะ จากของเหลวกลายเป็นไอ เช่น น้ำในสถานะของเหลว ณ อุณหภูมิห้อง เมื่อได้รับ ความร้อนจะระเหยกลายเป็นไอ ไอน้ำก็คือโมเลกุลของน้ำ ซึ่งแสดงว่าโมเลกุลของน้ำจะต้องมีแรงยึดเหนี่ยวระหว่างกันอยู่
2. แรงยึดเหนี่ยวภายในโมเลกุลโดยทั่วไป โมเลกุลของสารจะประกอบด้วยอะตอมตั้งแต่ 2 อะตอมขึ้นไป เช่น HCl, HNO3, NH3 เป็นต้น (ยกเว้นโมเลกุลของก๊าซเฉื่อยซึ่ง 1 โมเลกุลประกอบด้วยหนึ่งอะตอม เช่น He, Ne, Ar) จากการทดลองพบว่าการที่จะทำให้โมเลกุลเหล่านี้สลายตัวออกเป็นอะตอมต้องใช้พลังงานจำนวนหนึ่ง เช่น ถ้าต้องการจะทำลายพันธะระหว่างคาร์บอน-คาร์บอน ในอีเทน(ethane;H3C-CH3), เอทิลลีน(ethylene ; H2C=CH2) และ อะเซทิลีน(acetylene;HCºCH) พันธะของคาร์บอน-คาร์บอน ในโมเลกุลเหล่านี้เป็น พันธะเดี่ยว พันธะคู่ และพันธะสาม ตามลำดับ และพลังงานที่ใช้ในการสลายพันธะจะขึ้นอยู่กับชนิดของพันธะระหว่างคาร์บอน-คาร์บอน คือ
เมื่อ H = แทนพลังงานที่ถ่ายเทจากสิ่งแวดล้อมเข้าไปในโมเลกุล ส่วนเครื่องหมายบวก (+) หมายความว่า การสลายพันธะในโมเลกุลเป็นกระบวนการดูดความร้อน (endothermic) จากตัวอย่างข้างต้น แสดงให้เห็นว่าอะตอมของธาตุต้องมีแรงยึดเหนี่ยวระหว่างอะตอมในโมเลกุลและแรงยึดเหนี่ยวระหว่างอะตอมคู่หนึ่ง ๆ ในโมเลกุล เรียกว่า พันธะเคมี (chemical bond)
- แรงยึดเหนี่ยวระหว่างอะตอม (ภายในโมเลกุล)
แรงยึดเหนี่ยวระหว่างอะตอม แบ่งออกเป็น 3 ชนิด คือ
1. พันธะโลหะ (แรงดึงดูดระหว่างไอออนบวกกับเวเลนซ์อิเล็กตรอน)
2. พันธะไอออนิก (แรงดึงดูดระหว่างไอออนบวกกับไอออนลบ)
3. พันธะโคเวเลนต์ (แรงดึงดูดระหว่างอิเล็กตรอนที่แชร์กันกับนิวเคลียส)
- แรงยึดเหนี่ยวระหว่างโมเลกุล(เกิดเฉพาะในพันธะโคเวเลนต์ ใช้บอกจุดเดือด)เมื่อโมเลกุลหลายๆ โมเลกุลอยู่รวมกันเป็นกลุ่มเป็นก้อนได้นั้น จะต้องมีแรงยึดเหนี่ยวระหว่างโมเลกุลซึ่งยึดแต่ละโมเลกุลเหล่านั้น ตัวอย่างเช่น น้ำในแก้วหนึ่งประกอบด้วยโมเลกุลของน้ำจำนวนมากโดยที่แต่ละโมเลกุลยึดเหนี่ยวกันในรูปของของเหลว เมื่อให้ความร้อนแรงยึดเหนี่ยวระหว่างโมเลกุลของน้ำก็จะถูกทำลาย และทำให้โมเลกุลของน้ำเป็นอิสระจากกันได้ จึงอยู่ในสถานะก๊าซ
แรงยึดเหนี่ยวระหว่างโมเลกุล แบ่งออกเป็น 3 ชนิด ดังนี้1. แรงลอนดอน (ไม่มีขั้ว) เช่น F2(F-F F-F)2. แรงดึงดูดระหว่างขั้ว เช่น FCl ( F-Cl F-Cl )3. พันธะไฮโดรเจน เช่น H2O กับ H2O
แรงยึดเหนี่ยวระหว่างโมเลกุล (Van De Waals Interaction)
เนื่องจากโมเลกุลโควาเลนต์ปกติจะไม่ต่อเชื่อมกันแบบเป็นร่างแหอย่างพันธะโลหะหรือไอออนิก แต่จะมีขอบเขตที่แน่นอนจึงต้องพิจารณาแรงยึดเหนี่ยวระหว่างโมเลกุลด้วย ซึ่งจะเป็นส่วนที่ใช้อธิบายสมบัติทางกายภาพของโมเลกุลโควาเลนต์ อันได้แก่ ความหนาแน่น จุดเดือด จุดหลอมเหลว หรือความดันไอได้ โดยแรงยึดเหนี่ยวระหว่างโมเลกุลนั้นเกิดจากแรงดึงดูดเนื่องจากความแตกต่างของประจุเป็นสำคัญ ได้แก่
1. แรงลอนดอน ( London Force)เป็นแรงที่ เกิดจากการดึงดูดทางไฟฟ้าของโมเลกุลที่ไม่มีขั้วซึ่งแรงดึงดูดทางไฟฟ้านั้น เกิดได้จากการเลื่อนที่ของอิเล็กตรอนอย่างเสียสมดุลทำให้เกิดขั้วเล็กน้อย และขั้วไฟฟ้าเกิดขึ้นชั่วคราวนี้เอง จะเหนี่ยวนำกับโมเลกุลข้างเคียงให้มีแรงยึดเหนี่ยวเกิดขึ้น ดังภาพ

อิเล็กตรอนสม่ำเสมอ อิเล็กตรอนมีการเปลี่ยนแปลงตามเวลา
ดังนั้นยิ่งโมเลกุลมีขนาดใหญ่ก็จุยิ่งมีโอกาสที่อิเลคตรอนเคลื่อนที่ได้ เสียสมดุลมากจึงอาจกล่าวได้ว่าแรงลอนดอนแปรผันตรงกับขนาดของโมเลกุล เช่น F2Cl2Br2I2และ CO2เป็นต้น
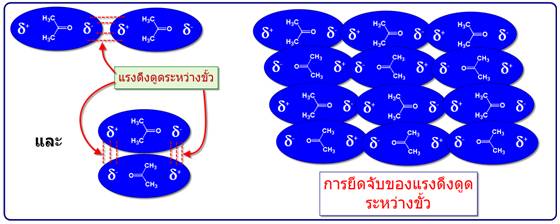
2. แรงดึงดูดระหว่างขั้ว (Dipole-Dipole interaction)เป็นแรงยึดเหนี่ยวที่เกิดระหว่างโมเลกุลที่มีขั้วสองโมเลกุลขึ้นไปเป็นแรงดึงดูดทางไฟฟ้าที่แข็งแรงกว่าแรงลอนดอน เพราะเป็นขั้นไฟฟ้าที่เกิดขึ้นอย่างถาวร โมเลกุลจะเอาด้านที่มีประจุตรงข้ามกันหันเข้าหากัน ตามแรงดึงดูดทางประจุ เช่น H2O HCl H2S และ CO เป็นต้น ดังภาพ
3. พันธะไฮโดรเจน (hydrogen bond)เป็น แรงยึดเหนี่ยวที่มีค่าสูงมาก โดยเกิดระหว่างไฮโดรเจนกับธาตุที่มีอิเล็กตรอนคู่โดดเดี่ยวเหลือ เกิดขึ้นได้ต้องมีปัจจัยต่างๆ ได้แก่ ไฮโดรเจนที่ขาดอิเล็กตรอนอันเนื่องจากถูกส่วนที่มีค่าอิเล็กโตรเนกาติวิตี สูงในโมเลกุลดึงไป จนกระทั้งไฮโดรเจนมีสภาพเป็นบวกสูงและจะต้องมีธาตุที่มีอิเลคตรอนคู่โดด เดี่ยวเหลือและมีความหนาแน่นอิเลคตรอนสูงพอให้ไฮโดรเจนที่ขาดอิเลคตรอนนั้น เข้ามาสร้างแรงยึดเหนี่ยวด้วยได้เช่น H2O HF NH3เป็นต้น ดังภาพ

แรงยึดเหนี่ยวภายในโมเลกุล แรงยึดเหนี่ยวระหว่างโมเลกุล
(พันธะโคเวเลนต์) (พันธะไฮโดรเจน)

แรงลอนดอน (London Force)
แรงลอนดอนเป็นแรงยึดเหนี่ยวระหว่างโมเลกุลยึดเหนี่ยวกันด้วยแรงอ่อนๆ ซึ่งเกิดขึ้นในสารทั่วไป และจะมีค่าเพิ่มขึ้นตามมวลโมเลกุลของสาร จัดเป็นแรงที่มีความแข็งแรงน้อยที่สุดในชนิดของแรงแวนเดอวาลล์ จึงต้องการพลังงานในการสลายพันธะหรือแรงระหว่างโมเลกุลน้อยมาก โมเลกุลที่ยึดจับกันด้วยแรงชนิดนี้มีจุดเดือด และจุดหลอม เหลวต่ำมาก
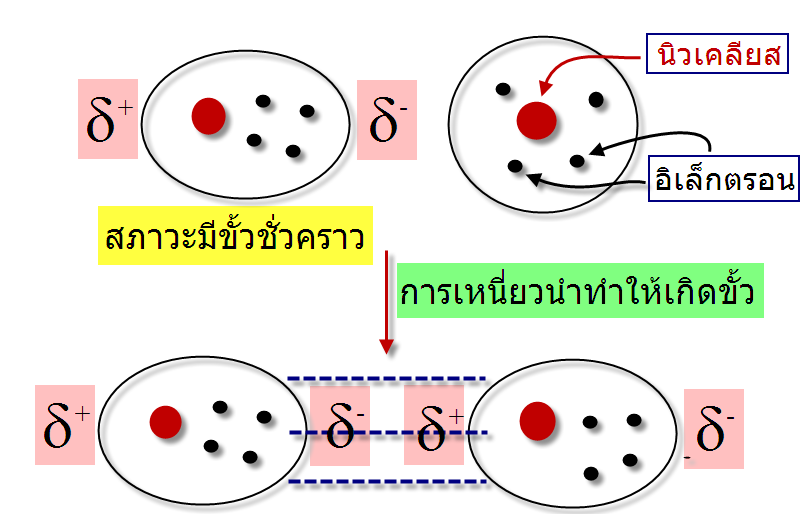
โดยปกติโมเลกุลที่ไม่มีขั้วจะประพฤติตัวเป็นกลางในบางครั้งอิเล็กตรอนเคลื่อนที่ไปรวมอยู่ด้านใดด้านหนึ่งของอะตอมหรือโมเลกุลทำให้เกิดสภาพขั้วชั่วคราวขึ้น โดยตำแหน่งที่อิเล็กตรอนเคลื่อนที่ไปรวมกันจะเกิดสภาพที่เป็นประจุลบ(d-)และตำแหน่งที่ไม่มีอิเล็กตรอนจะเกิดสภาพประจุที่เป็นบวก(d+)

โมเลกุลที่มีสภาพขั้วแบบชั่วคราวสามารถเหนี่ยวนำทำให้โมเลกุลในสภาวะปกติมีสภาพขั้วโดยที่ตำแหน่งที่มีอิเล็กตรอนหนาแน่นมีประจุเป็นลบจะไปผลักอิเล็กตรอนของอีกโมเลกุลให้ไปอยู่ด้านตรงข้ามทำให้เกิดอีกโมเลกุลมีสภาวะขั้วชั่วคราวอีกโมเลกุล ทำให้โมเลกุลทั้งสองมีประจุบวกและลบเรียกว่าPolarizabilityและเกิดแรงดึงดูดระหว่างประจุบวกและลบ ซึ่งแรงดึงดูดที่เกิดขึ้นดังลักษณะนี้เราเรียกว่า
แรงลอนดอน (Londondispersionforce)
แรงที่เกิดขึ้นนี้เกิดจากการที่อิเล็กตรอนเคลื่อนที่ไปรวมอยู่ด้านใดด้านหนึ่งของโมเลกุลทำให้เกิดสภาพขั้วชั่วคราวขึ้น และไม่สามารถเกิดขึ้นแบบถาวรจึงมีความแข็งแรงจึงน้อยมากพบว่าเมื่อโมเลกุลหรืออะตอมมีขนาดใหญ่ขึ้นจะมีความสามารถทำให้เกิดขั้ว(Polarizability)ได้ง่าย เนื่องจากเมื่ออิเล็กตรอนเคลื่อนที่ไปรวมที่ตำแหน่งใดตำแหน่งหนึ่งดังรูป พบว่าในกรณีโมเลกุลขนาดใหญ่จะมีความแตกต่างระหว่างขั้วมากกว่าจึงทำให้เกิดแรงดึงดูดระหว่างขั้วที่มากกว่าเช่นกันดังตัวอย่างCl2และBr2พบว่าBr2มีขนาดใหญ่กว่าจึงมีแรงดึงดูดระหว่างโมเลกุลมากกว่าทำให้จุดเดือดและจุดหลอมเหลวมากกว่าCl2
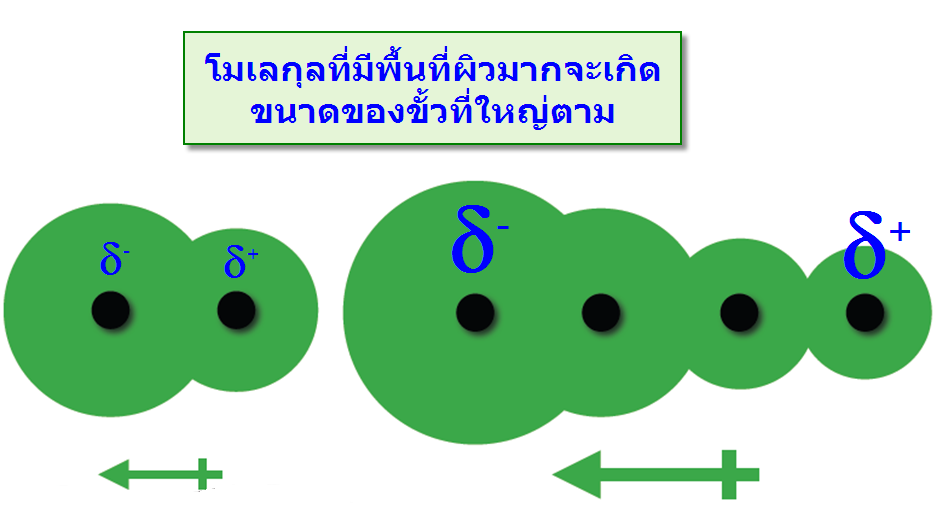
-พื้นที่ผิวของโมเลกุล:โมเลกุลที่มีพื้นที่ผิวมากจะทำให้ขนาดของประจุมีขนาดใหญ่ตาม เมื่อเปรียบเทียบสถานะของNeopentaneและn-Pentaneพบว่าที่อุณหภูมิห้องNeopentaneมีสมบัติเป็นก๊าซ แต่n-Pentaneเป็นของเหลว แสดงว่าn-Pentaneมีแรงระหว่างโมเลกุลมากกว่าNeopentaneทั้งนี้เป็นเพราะn-Pentaneมีพื้นที่ผิวมากกว่าทำให้ประจุที่เกิดขึ้นมีขนาดใหญ่ แรงระหว่างพันธะจึงมากตามไปด้วย
ลักษณะสำคัญของแรงลอนดอน
1.แรงลอนดอนเป็นแรงที่เกิดขึ้นช่วงสั้น ๆ และจะเกิดเฉพาะส่วนของโมเลกุลที่เข้าใกล้ชิดกันเท่านั้น โดยเกิดขึ้นระหว่างพื้นผิวของโมเลกุลต่อโมเลกุล
2.แรงลอนดอนมีความแข็งแรงประมาณ ถึง
ถึง ของความแรงของพันธะโควาเลนต์
ของความแรงของพันธะโควาเลนต์
 ถึง
ถึง ของความแรงของพันธะโควาเลนต์
ของความแรงของพันธะโควาเลนต์
ปัจจัยที่มีผลต่อแรงลอนดอนของสารโควาเลนต์
1. มวลโมเลกุล แรงลอนดอน จะเพิ่มตามมวลโมเลกุลของสาร
2. ขนาด รูปร่าง และพื้นที่ผิวของโมเลกุล ในกรณีที่สารเหล่านั้นมีมวลโมเลกุลเท่ากันหรือใกล้เคียงกันแรงแวนเดอวาลส์เพิ่มตามขนาดและพื้นที่ผิวของโมเลกุลของสาร
แรงชนิดนี้จะมีความแข็งแรงมากขึ้นถ้าโมเลกุลมีขนาดใหญ่ขึ้น นั่นเป็นเพราะว่าโมเลกุลขนาดใหญ่กว่าจะมีอิเล็กตรอนมากกว่า ซึ่งบางครั้งอิเล็กตรอนเหล่านั้นมารวมกันอยู่ ณ บริเวณหนึ่งๆในอะตอมมากกว่าบริเวณหนึ่งทำให้เกิดประจุบางส่วนขึ้น แต่เนื่องจากมีจำนวนอิเล็กตรอนมากดังนั้นประจุที่เกิดจึงมีค่ามากกว่าจึงเหนี่ยวนำให้เกิดประจุที่แข็งแรงกว่า


พันธะโฮโดรเจน (Hydrogen bonding,H – bond)
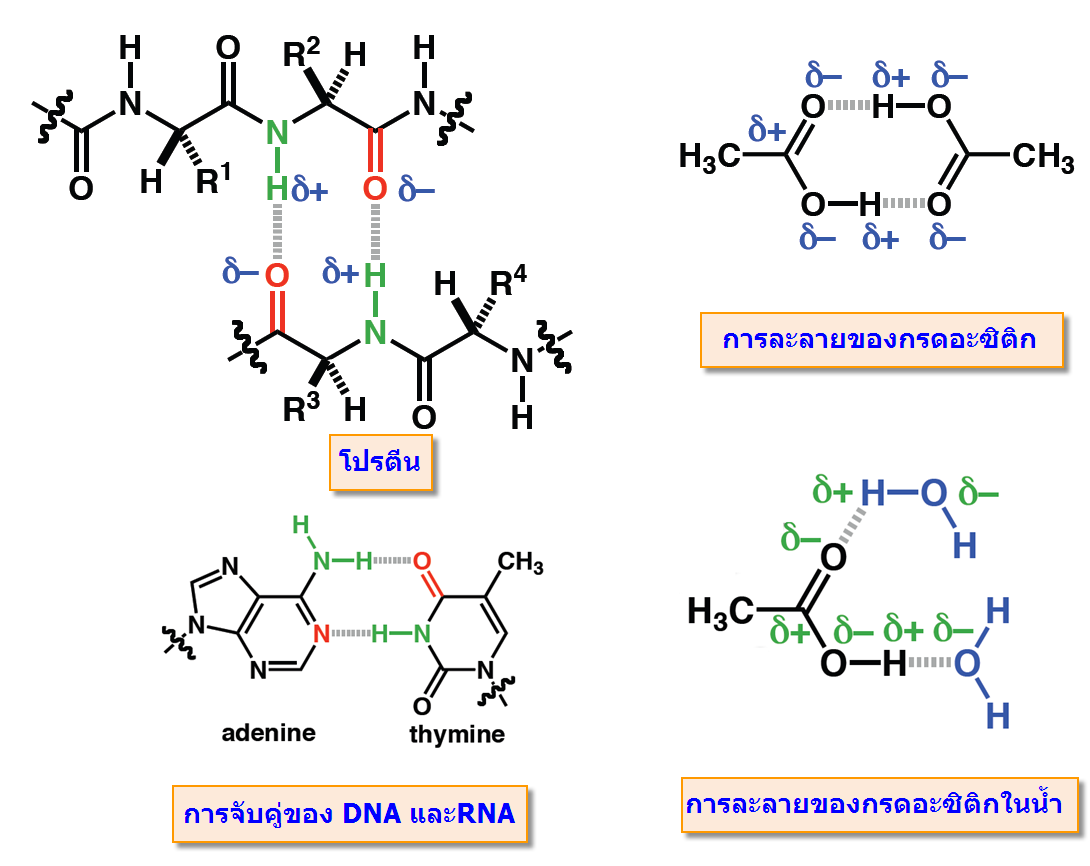
คือ แรงดึงดูดระหว่างโมเลกุลที่เกิดจากไฮโดรเจนอะตอมสร้างพันธะโคเวเลนต์ กับอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีสูงๆและมีขนาดเล็ก ได้แก่ F , O และ N แล้วเกิดพันธะโคเวเลนต์มีขั้วชนิดมีสภาพขั้วแรงมาก ทั้งนี้เนื่องจากพันธะที่เกิดขึ้นนี้อิเล็กตรอนคู่รวมพันธะจะถูกดึงเข้ามาใกล้อะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูง มากกว่าทางด้านอะตอมของไฮโดรเจนมาก และอะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูง ยังมีอิเล็กตรอนคู่โดดเดี่ยว จึงเกิดดึงดูดกันระหว่างอิเล็กตรอนคู่โดดเดี่ยวกับอะตอมของไฮโดรเจนชึ่งมีอำนาจไฟฟ้าบวกสูงของอีกโมเลกุลหนึ่ง ทำให้เกิดเป็นพันธะไฮโดรเจนมีบทบาทสำคัญกับขบวนการที่สำคัญของสิ่งมีชีวิต ไม่ว่าเป็นการจับกันระหว่างโมเลกุลของโปรตีน และการจับเข้าคู่กับของDNAและRNA

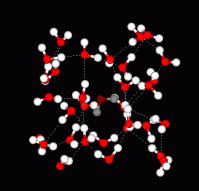
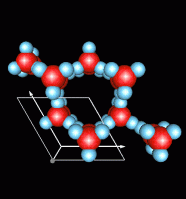
ในกรณีของน้ำแข็งโมเลกุลของน้ำแต่ละโมเลกุลสร้างพันธะไฮโดรเจนกับโมเลกุลอื่นๆอีก 4 โมเลกุลเช่นเดียวกัน แต่มีความเป็นระเบียบมากกว่า โดยระยะห่างระหว่างออกซิเจนของโมเลกุลของตัวมันเองกับโมเลกุลใกล้เคียงมีค่าประมาณ 2.76 อังสตรอม (Ao) ผลึกของน้ำแข็งมีได้หลายรูป แต่รูปที่พบในธรรมชาติ คือ hexagonal


เพื่อความเข้าใจมากขึ้นขออธิบายพันธะไฮโดรเจนผ่านกระบวนการการเกิดเป็นน้ำแข็งของน้ำ ซึ่งจะช่วยให้แยกแยะระหว่างพันธะโคเวเลนต์กับพันธะไฮโดรเจนได้เป็นอย่างดี
น้ำ 1 โมเลกุลประกอบด้วย


ออกซิเจนซึ่งมีเวเลนซ์อิเล็กตรอนเท่ากับ 6 ดังนั้นเมื่อใช้อิเล็กตรอนไป 2 ตัวเพื่อเกิดพันธะโคเวเลนต์กับ H สองอะตอม (อะตอมละ 1 อิเล็กตรอน) จึงเหลือ 4 อิเล็กตรอนหรือมีอิเล็กตรอนคู่โดดเดี่ยว 2 คู่ ดังรูป

ดังนั้นน้ำแข็งจึงเกิดจากโมเลกุลของน้ำหลายๆโมเลกุลเชื่อมกัน หรืออาจกล่าวได้ว่าอะตอมของ O เชื่อมกันโดยอาศัยพันธะโคเวเลนต์และพันธะไฮโดรเจนร่วมกัน โดย 1 อะตอมของออกซิเจนจะเชื่อมกับอีก 4 อะตอมของออกซิเจน
สภาพขั้วของโมเลกุลน้ำและก๊าซคาร์บอนไดออกไซด์
 การเกิดพันธะไฮโดรเจนของโมเลกุลน้ำ
การเกิดพันธะไฮโดรเจนของโมเลกุลน้ำ
 ลักษณะสำคัญของพันธะไฮโดรเจน
ลักษณะสำคัญของพันธะไฮโดรเจน
1. ต้องเป็นโมเลกุลที่พันธะมีขั้วแรง ๆ และมีไฮโดรเจนสร้างพันธะกับอะตอมของธาตุที่มีค่าอิเล็กโตรเนกาติวิตีสูง และมีขนาดเล็ก
มีอิเล็กตรอนคู่โดดเดี่ยวเหลืออย่างน้อย 1 คู่ เช่น F , O , N
2. ระบบที่มีการเกิดพันธะไฮโดรเจนเป็นแบบคายพลังงาน ความแข็งแรงของพันธะไฮโดรเจนของสารทั่วไป
แรงแวนเดอร์วาลส์ : พันธะไฮโดรเจน : พันธะโควาเลนต์ = 1 : 10 : 100
3. พันธะไฮโดรเจนที่เกิดกับธาตุ F , O , N เป็นพันธะไฮโดรเจนที่แรง (Strong hydrogen bond)
4. พันธะไฮโดรเจนจะมีความแข็งแรงมากน้อยแค่ไหนขึ้นอยู่กับค่าอิเล็กโตรเนกาติวิตีของธาตุที่มีขนาดอะตอมเล็กนั้น กล่าวคือ ธาตุที่มีค่าอิเล็กโตรเนกาติวิตีสูงเกิดพันธะกับไฮโดรเจนก็จะมีสภาพมีขั้วแรงได้พันธะไฮโดรเจนที่แข็งแรงกว่า ธาตุที่มีค่า
อิเล็กโตรเนกาติวิตีต่ำกว่าสร้างพันธะกับไฮโดรเจน
5. ความยาวพันธะไฮโดรเจนจะยาวกว่าความยาวพันธะโควาเลนต์ที่เกิดจากคู่อะตอมของธาตุคู่เดียวกัน เช่น

6. สารโควาเลนต์ที่เกิดพันธะไฮโดรเจนได้จะมีจุดเดือดจุดหลอมเหลวสูงกว่าสารโควาเลนต์ที่มีแต่แรงแวนเดอร์วาลส์เท่านั้น
7. พันธะไฮโดรเจนในน้ำแข็ง น้ำแข็งมีโครงสร้างเป็นโครงผลึกร่างตาข่าย โดยโมเลกุลของน้ำแต่ละโมเลกุลเกิดพันธะไฮโดรเจนได้ถึง4 พันธะ ในลักษณะทรงสี่หน้า ทำให้โครงผลึกของน้ำแข็งเป็นโพรงและมีความหนาแน่นน้อยชนิดของพันธะไฮโดรเจน
1. พันธะไฮโดรเจนระหว่างโมเลกุล (Intermolecular hydrogen bond)
เป็นพันธะไฮโดรเจนที่เกิดจากแรงดึงดูดทางไฟฟ้าระหว่างโมเลกุลกับโมเลกุล
2. พันธะไฮโดรเจนภายในโมเลกุล (Intramolecular hydrogen bond) เป็นพันธะไฮโดรเจนที่เกิดจากแรงดึงดูดทางไฟฟ้า
ภายในโมเลกุลที่มีขนาดใหญ่และยาว เช่น พันธะไฮโดรเจนในกรดมาลิอิก (maleic acid) สูตรเคมี (HOOCH = CHOOH)

3.4 พันธะโลหะ
พันธะโลหะ หมายถึง แรงยึดเหนี่ยวที่ทำให้อะตอมของโลหะ อยู่ด้วยกันในก้อนของโลหะ โดยมีการใช้เวเลนต์อิเล็กตรอนร่วมกันของอะตอมของโลหะ โดยที่เวเลนต์อิเล็กตรอนนี้ไม่ได้เป็นของอะตอมหนึ่งอะตอมใดโดยเฉพาะ เนื่องจากมีการเคลื่อนที่ตลอดเวลา ทุกๆอะตอมของโลหะจะอยู่ติดกันกับอะตอมอื่นๆ ต่อเนื่องกันไม่มีที่สิ้นสุด จึงทำให้โลหะไม่มีสูตรโมเลกุล ที่เขียนกันเป็นสูตรอย่างง่าย หรือสัญลักษณ์ของธาตุนั้นเอง
1. มวลโมเลกุล แรงลอนดอน จะเพิ่มตามมวลโมเลกุลของสาร
2. ขนาด รูปร่าง และพื้นที่ผิวของโมเลกุล ในกรณีที่สารเหล่านั้นมีมวลโมเลกุลเท่ากันหรือใกล้เคียงกันแรงแวนเดอวาลส์เพิ่มตามขนาดและพื้นที่ผิวของโมเลกุลของสาร
แรงชนิดนี้จะมีความแข็งแรงมากขึ้นถ้าโมเลกุลมีขนาดใหญ่ขึ้น นั่นเป็นเพราะว่าโมเลกุลขนาดใหญ่กว่าจะมีอิเล็กตรอนมากกว่า ซึ่งบางครั้งอิเล็กตรอนเหล่านั้นมารวมกันอยู่ ณ บริเวณหนึ่งๆในอะตอมมากกว่าบริเวณหนึ่งทำให้เกิดประจุบางส่วนขึ้น แต่เนื่องจากมีจำนวนอิเล็กตรอนมากดังนั้นประจุที่เกิดจึงมีค่ามากกว่าจึงเหนี่ยวนำให้เกิดประจุที่แข็งแรงกว่า
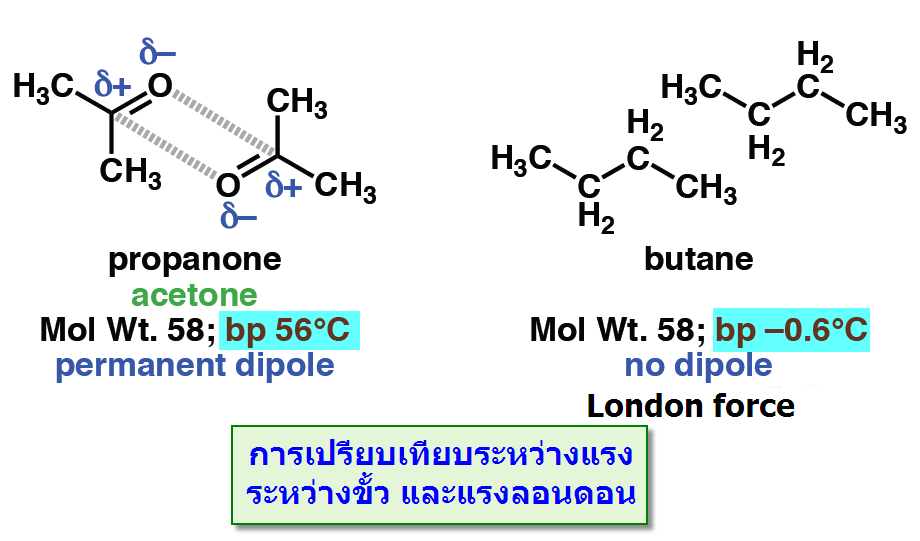
แรงดึงดูดระหว่างขั้ว (Dipole – dipole force)
เป็นแรงดึงดูดทางไฟฟ้าอันเนื่องมาจากแรงกระทำระหว่างขั้วบวกกับขั้วลบของโมเลกุลที่มีขั้วจัดเป็นแรงที่เกิดจากขั้วถาวรดึงดูดกันเองระหว่างขั้วบวกและขั้วลบซึ่งดึงดูดได้สองแบบดังตัวอย่างของอะซิโตน

แรงไดโพลมีบทบาทสำคัญในการจัดเรียงตัวที่เป็นระเบียบของโมเลกุลในผลึก สำหรับโมเลกุลในสถานะแก๊สและของเหลว โมเลกุลมีการจัดเรียงตัวอย่างไม่เป็นระเบียบ เพราะมีการเคลื่อนไหวมากจึงเป็นผลให้แรงไดโพลมีทั้งแบบผลักและดึงดูด ซึ่งทำให้แรงลัพธ์ออกมา เป็นแรงดึงดูดอย่างอ่อนๆ เมื่อนำมาเปรียบเทียบระหว่างแรงดึงดูดระหว่างขั้ว(Dipole -dipole forces)กับแรงลอนดอน(London dispersion forces) โดยที่โมเลกุลมีขนาดพอๆกัน พบว่าแรงดึงดูดระหว่างขั้วมีความแข็งแรงมากกว่าดังตัวอย่างของ อะซิโตน มีจุดเดือดเท่ากับ 56oCกับButaneมีจุดเดือดเท่ากับ -0.6oC (พิจารณาจากสารประกอบที่มีจุดเดือดสูงกว่าต้องมีแรงระหว่างโมเลกุลมากกว่า)

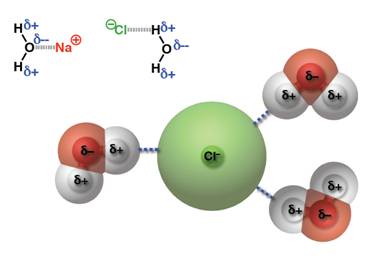
- แรงดึงดูดระหว่างไอออนกับขั้ว(Ion-dipoleforces)เป็นแรงที่เกิดจากไอออนกับสารประกอบที่มีขั้วจัดเป็นแรงที่มีความแข็งแรงมากกว่าแรงระหว่างขั้ว(Dipole-dipole forces)เช่นการละลายของNaClใน น้ำNa+ที่มีประจุเป็นบวกจะเกิดแรงดึงดูดกับออกซิเจนซ์ของน้ำและCl-จะเกิดแรงดึงดูดกับHของน้ำเช่นกัน ดังตัวอย่าง

แรง dipole-induced dipoleคือ แรงที่เกิดจากโมเลกุลที่มีขั้วเหนี่ยวนำให้โมเลกุล หรืออะตอมตัวอื่นมีขั้วด้วย จากนั้นอะตอมหรือโมเลกุลดังกล่าวก็มีแรงกระทำต่อกันเกิดขึ้น ซึ่งแรงนี้จะมากหรือน้อยขึ้นอยู่กับความสามารถในการเกิดมีขั้ว (polarizability) ของโมเลกุลที่ถูกเหนี่ยวนำ โดยทั่วไปอะตอมหรือโมเลกุลที่มีขนาดใหญ่ จะมีความสามารถในการเกิดมีขั้วสูงกว่า อะตอมหรือโมเลกุลที่มีขนาดเล็ก
การเกิดแรง dipole-induced dipoleเช่น HCl กับ Ar แสดงได้ดังรูป
การเกิดแรง dipole-induced dipoleเช่น HCl กับ Ar แสดงได้ดังรูป

พันธะโฮโดรเจน (Hydrogen bonding,H – bond)
คือ แรงดึงดูดระหว่างโมเลกุลที่เกิดจากไฮโดรเจนอะตอมสร้างพันธะโคเวเลนต์ กับอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีสูงๆและมีขนาดเล็ก ได้แก่ F , O และ N แล้วเกิดพันธะโคเวเลนต์มีขั้วชนิดมีสภาพขั้วแรงมาก ทั้งนี้เนื่องจากพันธะที่เกิดขึ้นนี้อิเล็กตรอนคู่รวมพันธะจะถูกดึงเข้ามาใกล้อะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูง มากกว่าทางด้านอะตอมของไฮโดรเจนมาก และอะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูง ยังมีอิเล็กตรอนคู่โดดเดี่ยว จึงเกิดดึงดูดกันระหว่างอิเล็กตรอนคู่โดดเดี่ยวกับอะตอมของไฮโดรเจนชึ่งมีอำนาจไฟฟ้าบวกสูงของอีกโมเลกุลหนึ่ง ทำให้เกิดเป็นพันธะไฮโดรเจนมีบทบาทสำคัญกับขบวนการที่สำคัญของสิ่งมีชีวิต ไม่ว่าเป็นการจับกันระหว่างโมเลกุลของโปรตีน และการจับเข้าคู่กับของDNAและRNA


ในกรณีของน้ำแข็งโมเลกุลของน้ำแต่ละโมเลกุลสร้างพันธะไฮโดรเจนกับโมเลกุลอื่นๆอีก 4 โมเลกุลเช่นเดียวกัน แต่มีความเป็นระเบียบมากกว่า โดยระยะห่างระหว่างออกซิเจนของโมเลกุลของตัวมันเองกับโมเลกุลใกล้เคียงมีค่าประมาณ 2.76 อังสตรอม (Ao) ผลึกของน้ำแข็งมีได้หลายรูป แต่รูปที่พบในธรรมชาติ คือ hexagonal



เพื่อความเข้าใจมากขึ้นขออธิบายพันธะไฮโดรเจนผ่านกระบวนการการเกิดเป็นน้ำแข็งของน้ำ ซึ่งจะช่วยให้แยกแยะระหว่างพันธะโคเวเลนต์กับพันธะไฮโดรเจนได้เป็นอย่างดี
น้ำ 1 โมเลกุลประกอบด้วย


ออกซิเจนซึ่งมีเวเลนซ์อิเล็กตรอนเท่ากับ 6 ดังนั้นเมื่อใช้อิเล็กตรอนไป 2 ตัวเพื่อเกิดพันธะโคเวเลนต์กับ H สองอะตอม (อะตอมละ 1 อิเล็กตรอน) จึงเหลือ 4 อิเล็กตรอนหรือมีอิเล็กตรอนคู่โดดเดี่ยว 2 คู่ ดังรูป

ดังนั้นน้ำแข็งจึงเกิดจากโมเลกุลของน้ำหลายๆโมเลกุลเชื่อมกัน หรืออาจกล่าวได้ว่าอะตอมของ O เชื่อมกันโดยอาศัยพันธะโคเวเลนต์และพันธะไฮโดรเจนร่วมกัน โดย 1 อะตอมของออกซิเจนจะเชื่อมกับอีก 4 อะตอมของออกซิเจน
สภาพขั้วของโมเลกุลน้ำและก๊าซคาร์บอนไดออกไซด์


1. ต้องเป็นโมเลกุลที่พันธะมีขั้วแรง ๆ และมีไฮโดรเจนสร้างพันธะกับอะตอมของธาตุที่มีค่าอิเล็กโตรเนกาติวิตีสูง และมีขนาดเล็ก
มีอิเล็กตรอนคู่โดดเดี่ยวเหลืออย่างน้อย 1 คู่ เช่น F , O , N
2. ระบบที่มีการเกิดพันธะไฮโดรเจนเป็นแบบคายพลังงาน ความแข็งแรงของพันธะไฮโดรเจนของสารทั่วไป
แรงแวนเดอร์วาลส์ : พันธะไฮโดรเจน : พันธะโควาเลนต์ = 1 : 10 : 100
3. พันธะไฮโดรเจนที่เกิดกับธาตุ F , O , N เป็นพันธะไฮโดรเจนที่แรง (Strong hydrogen bond)
4. พันธะไฮโดรเจนจะมีความแข็งแรงมากน้อยแค่ไหนขึ้นอยู่กับค่าอิเล็กโตรเนกาติวิตีของธาตุที่มีขนาดอะตอมเล็กนั้น กล่าวคือ ธาตุที่มีค่าอิเล็กโตรเนกาติวิตีสูงเกิดพันธะกับไฮโดรเจนก็จะมีสภาพมีขั้วแรงได้พันธะไฮโดรเจนที่แข็งแรงกว่า ธาตุที่มีค่า
อิเล็กโตรเนกาติวิตีต่ำกว่าสร้างพันธะกับไฮโดรเจน
5. ความยาวพันธะไฮโดรเจนจะยาวกว่าความยาวพันธะโควาเลนต์ที่เกิดจากคู่อะตอมของธาตุคู่เดียวกัน เช่น

6. สารโควาเลนต์ที่เกิดพันธะไฮโดรเจนได้จะมีจุดเดือดจุดหลอมเหลวสูงกว่าสารโควาเลนต์ที่มีแต่แรงแวนเดอร์วาลส์เท่านั้น
7. พันธะไฮโดรเจนในน้ำแข็ง น้ำแข็งมีโครงสร้างเป็นโครงผลึกร่างตาข่าย โดยโมเลกุลของน้ำแต่ละโมเลกุลเกิดพันธะไฮโดรเจนได้ถึง4 พันธะ ในลักษณะทรงสี่หน้า ทำให้โครงผลึกของน้ำแข็งเป็นโพรงและมีความหนาแน่นน้อยชนิดของพันธะไฮโดรเจน
1. พันธะไฮโดรเจนระหว่างโมเลกุล (Intermolecular hydrogen bond)
เป็นพันธะไฮโดรเจนที่เกิดจากแรงดึงดูดทางไฟฟ้าระหว่างโมเลกุลกับโมเลกุล
2. พันธะไฮโดรเจนภายในโมเลกุล (Intramolecular hydrogen bond) เป็นพันธะไฮโดรเจนที่เกิดจากแรงดึงดูดทางไฟฟ้า
ภายในโมเลกุลที่มีขนาดใหญ่และยาว เช่น พันธะไฮโดรเจนในกรดมาลิอิก (maleic acid) สูตรเคมี (HOOCH = CHOOH)


3.3.7 สารโคเวเลนต์โครงร่างตาข่าย
อโลหะส่วนใหญ่อยู่ในรูปโมเลกุลเดียว มีจุดหลอมเหลว จุดเดือดต่ำ แต่อโลหะบางชนิดมีจุดหลอมเหลว และจุดเดือดสูง
บางชนิดนำไฟฟ้าได้อีกด้วย สารพวกนี้ ได้แก่ สารที่มีโครงสร้างแบบโครงผลึกร่างตาข่าย สารพวกนี้อะตอมยึดเหนี่ยวกันด้วย
พันธะโควาเลนต์รูปแบบต่อเนื่องกันคล้ายตาข่ายสามมิติบ้าง สองมิติบ้าง สารพวกนี้ไม่มีสูตรโมเลกุล เขียนได้แต่สูตรอย่างง่าย
สารพวกนี้ได้แก่ คาร์บอนในรูปเพชร แกรไฟต์ และฟลูเลอรีน ฟอสฟอรัสในรูปของ ฟอสฟอรัสขาว ฟอสฟอรัสแดง และ
ฟอสฟอรัสดำ นอกจากนั้นยังมีสารประกอบบางชนิดก็เป็นสารโครงผลึกร่างตาข่าย เช่น ซิลิก้า หรือซิลิคอนไดออกไซด์ (SiO2)
ซิลิคอนคาร์ไบด์ หรือคาร์บอรันดัม (SiC)
3.4 พันธะโลหะ
พันธะโลหะ หมายถึง แรงยึดเหนี่ยวที่ทำให้อะตอมของโลหะ อยู่ด้วยกันในก้อนของโลหะ โดยมีการใช้เวเลนต์อิเล็กตรอนร่วมกันของอะตอมของโลหะ โดยที่เวเลนต์อิเล็กตรอนนี้ไม่ได้เป็นของอะตอมหนึ่งอะตอมใดโดยเฉพาะ เนื่องจากมีการเคลื่อนที่ตลอดเวลา ทุกๆอะตอมของโลหะจะอยู่ติดกันกับอะตอมอื่นๆ ต่อเนื่องกันไม่มีที่สิ้นสุด จึงทำให้โลหะไม่มีสูตรโมเลกุล ที่เขียนกันเป็นสูตรอย่างง่าย หรือสัญลักษณ์ของธาตุนั้นเอง3.4.1 การเกิดพันธะโลหะ
1. โลหะมีค่าพลังงานไอออไนเซชั่นต่ำมาก แสดงว่าอิเล็กตรอนของโลหะจะหลุดออกไปได้ง่าย เมื่อ
เวเลนซ์อิเล็กตรอนหลุดออกไป ก็จะเหลืออนุภาคบวกดังนี้
 |
| โลหะทุกอะตอมเป็นตัวให้อิเล็กตรอนทั้งสิ้นดังนั้นจะไม่มีอะตอมใดเลยที่ได้รับอิเล็กตรอน |
2. โลหะมีเวเลนซ์อิเล็กตรอนน้อย ดังนั้นอิเล็กตรอนที่หลุดออกไป จะมีเพียง 1,2,3 ตัวเท่านั้น
3. โลหะมีค่าโคออร์ดิเนชั่นนัมเบอร์สูง ซึ่งเท่ากับ 8 หรือ12 หมายความว่า อะตอมหนึ่งจะมีอะตอมอื่นรอบล้อม 8 ถึง12 อะตอมดังนั้นการนำอิเล็กตรอนมาใช้ร่วมกันเป็นอิเล็กตรอนคู่ในลักษณะของพันธะโคเวเลนต์จึงเป็นไปไม่ได้
ดังนั้นการเกิดพันธะโลหะควรเป็นไปในลักษณะที่ว่าเวเลนซ์อิเล็กตรอนของอะตอมโลหะ ที่หลุดออกไปจะไม่เป็นของอะตอมใดอะตอมหนึ่งโดยเฉพาะแต่จะเป็นของอะตอมทั้ง หมด โดยที่อิเล็กตรอนจะเคลื่อนที่ไปยังอะตอมนี้บ้างอะตอมโน้นบ้าง ในผลึกของโลหะจึงเป็นการเอาอนุภาคบวกมาเรียงกัน ไว้อย่างมีระเบียบ และมีเวเลนซ์อิเล็กตรอนเคลื่อนที่ไปมาได้ทั่วอนุภาคบวกทั้งหมด หรืออาจกล่าวได้ว่า อนุภาคบวกเหล่านั้นจมอยู่ในทะเลอิเล็กตรอน แรงดึงดูดระหว่างอนุภาคบวกกับอิเล็กตรอนเรียกว่า “พันธะโลหะ” ซึ่งมีแรงยึดเหนี่ยวระหว่างพันธะแข็งแรงมาก

3.4.2 สมบัติของโลหะ
1.โลหะมีจุดหลอมเหลวและจุดเดิอดสูง เนื่องจากเกิดแรงยึดเหนี่ยวระหว่างอิเล็กตรอนกับอะตอมทั่วทั้งก้อนทำให้แรงนี้มีค่ามาก เมื่อต้องการทำให้โลหะเปลี่ยนสถาระจึงต้องใช้พลังงานมากผลให้จุดเดือดและจุดหลอมเหลวสูงด้วย2.โลหะนำไฟฟ้าได้ดีเพราะมีอิเล็กตรอนอิสระเคลื่อนที่ไปในทิสทางเดียวกัน เมื่อมีกระแสไฟฟ้าไหลผ่านโลหะจะนำไฟฟ้าได้
3.โลหะถูกทุบให้เป็นแผ่นดึงให้เป็นเส้นได้ เมื่อออกแรงทุบโลหะจะทำให้อะตอมของโลหะเลื่อนไถลตามกันไปแต่ไม่หลุดแยกออกจากกัน เพราะมีแรงยึดเหนี่ยวระหว่างอะตอมสูงแมื่อออกแรงทุบมากๆ อะตอมก็เลื่อนไถลออกไปมากทำให้เพิ่มพื้นที่ผิวมากขึ้นแต่อะตอมก็ยังไม่หลุดออดจากกัน
4.โลหะจะมีผิวเป็นมันวาว เนื่องจากกลุ่มอิเล็กตรอนเมื่อกระทบกับแสงก็จะรับคลื่นแสงซึ่งเป็นคลื่นแม่เหล็กไฟฟ้าแล้วกระจายแสงออกทำให้ผิวของโลหะเป็นมันวาว
5.โลหะถูกดึงอิเล็กตรอนออกดไ้ง่าย เนื่องจากอะตอมของโลหะปล่อยอิเล็กตรอนอิสระออกมาตลอดเวลา อะตอมจึงมีโอกาสที่จะสูญเสียอิเล็กตรอนได้ง่าย
3.5 การใช้ประโยชน์ของสารประกอบไอออนิก สารโคเวเลนต์ และโลหะ
จากการที่สารประกอบไอออนิก สารโคเวเลนต์ และโลหะ มีสมบัติเฉพาะตัวบางประการที่แตกต่างกัน เช่น จุดเดือด จุดหลอมเหลว การนำไฟฟ้า การละลายน้ำ จึงสามารถนำมาใช้ประโยชน์ในด้านต่างๆ ได้ตามความเหมาะสม เช่น
- แอมโมเนียมคลอไรด์ และซิงค์คอลไรด์ เป็นสารประกอบไอออนิก ที่สามารถ นำไฟฟฟ้าได้จากการแตกตัวเป็นไอออนเมื่อละลายน้ะ จึงนำไปใช้เป็นสารสารละลายอิเล็กโทรไลต์ในถ่านไฟฉาย
- พอลิไวนิลคลอไรด์หรือพีวีซี เป็ฯสารโคเวเลนต์ ที่ไม่สามารถนำไฟฟ้าได้ จึงนำไปใช้เป็นฉนวนไฟฟ้าที่หุ้มสายไฟฟ้า
- ซิลิคอนคาร์ไบด์ เป็นสารโคเวเลนต์โครงร่างตาข่าย ที่มีจุดหลอมเหลวสูงถึง 2830 องศาเซลเซียสและมีความแข็งแรงมาก จึงนำไปใช้ทำเครื่องบด เครื่องโม่ หรือหินลับมีด
- ทองแดงและอะลูมิเนียม เป็นโลหะที่นำไฟฟ้าได้ดี จึงนำไปใช้เป็นตัวนำไฟฟ้า โดยโลหะทองแดงนำไฟฟ้าได้ดีกว่าโลหะอะลูมิเนียม
- อะลูมิเนียมและเหล็ก เป็นโลหะที่นำความร้อนได้ดี จึงนำไปใช้ทำภาชนะสำหรับประกอบอาหาร เช่น หม้อ กระทะ










ไม่มีความคิดเห็น:
แสดงความคิดเห็น